
 Al(OH)3+OH-.
Al(OH)3+OH-.
分析 (1)NaAlO2為強堿弱酸鹽,水解呈堿性;
(2)計算鐵的物質的量為0.1mol,0.1mol鐵在金屬鐵與鹽酸完全反應生成氯化亞鐵溶液與氫氣,同時放出熱量QKJ則1mol鐵與鹽酸反應放出10QkJ熱量;
(3)該燃料電池中,通入CO的一極為原電池的負極,發生氧化反應,電極反應式為2CO-4e-+2CO32-═4CO2,通入氧氣和CO2的混合氣體一極為原電池的正極,發生還原反應,電極反應式為O2+4e-+2CO2═2CO32-;
(4)FeCl3與銅反應生成氯化亞鐵與氯化銅;
(5)根據電池反應式設計原電池,由發生反應的反應類型設計正負極,將發生氧化反應的金屬單質設計成負極,比負極不活潑的金屬或導電的非金屬設計成正極,反應物中的電解質設計為電解質溶液.
解答 解:(1)NaAlO2為強堿弱酸鹽,水解呈堿性,水解的離子方程式為AlO2-+2H2O Al(OH)3+OH-,故答案為:AlO2-+2H2O
Al(OH)3+OH-,故答案為:AlO2-+2H2O Al(OH)3+OH-;
Al(OH)3+OH-;
(2)n(Fe)=$\frac{5.6g}{56g/mol}$=0.1mol,0.1mol金屬鐵與鹽酸完全反應生成氯化亞鐵溶液與氫氣,同時放出熱量QKJ,其熱化學反應方程式為Fe(S)+2HCl(aq)=FeCl2(aq)+H2(g)△H=-10 Q kJ/mol,故答案為:Fe(S)+2HCl(aq)=FeCl2(aq)+H2(g)△H=-10 Q kJ/mol;
(3)通入CO的一極為原電池的負極,發生氧化反應,電極反應式為2CO-4e-+2CO32-═4CO2,正極上的電極反應式為O2+4e-+2CO2═2CO32-,
故答案為:2CO2+4e-+O2=2CO32-;
(4)FeCl3與銅反應生成氯化亞鐵與氯化銅,反應的離子方程式為2Fe3++Cu=2Fe2++Cu2+,故答案為:2Fe3++Cu=2Fe2++Cu2+;
(5)設計成原電池時,負極上發生氧化反應,正極上發生還原反應,該電池反應中三價鐵離子得電子發生還原反應,所以正極上的電極反應式為Fe3++e-=Fe2+(或2Fe3++2e-=2Fe2+),銅失電子發生氧化反應,所以負極上的電極反應式為Cu=2Cu2++2e-(或Cu-2e-=Cu2+);
電池反應中發生氧化反應的金屬作負極,所以銅作負極,不如負極活潑的金屬或導電的非金屬作正極,可選石墨作正極,發生還原反應的電解質溶液作原電池的電解質溶液,所以該原電池圖為 ,故答案為:
,故答案為: .
.
點評 本題綜合考查化學用語,為高頻考點,側重于學生雙基的考查,注意把握物質的性質以及原電池工作原理,難度中等.


 期末1卷素質教育評估卷系列答案
期末1卷素質教育評估卷系列答案科目:高中化學 來源: 題型:選擇題
| A. | 在乙醇分子間,既存在分子間作用力又存在氫鍵 | |
| B. | 帶相反電荷離子之間的相互吸引稱為離子鍵 | |
| C. | 同素異形體間的相互轉化屬于物理變化 | |
| D. | H2O比H2S穩定,因為水分子間有氫鍵 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 人體運動所消耗的能量與化學反應有關 | |
| B. | 煤和石油都屬于化石燃料 | |
| C. | 化學反應必然伴隨發生能量變化 | |
| D. | 不需要加熱就能進行的反應都是放熱反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 ,CO的結構可以表示為
,CO的結構可以表示為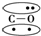 ,其中橢圓框表示π鍵,下列說法中不正確的是( )
,其中橢圓框表示π鍵,下列說法中不正確的是( )| A. | N2分子與CO分子中都含有叁鍵 | B. | CO分子中有一個π鍵是配位鍵 | ||
| C. | N2與CO互為等電子體 | D. | N2與CO的化學性質相同 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | HCl的電子式為 | |
| B. | S2-的結構示意圖為 | |
| C. | O-16原子的符號為${\;}_{6}^{16}O$ | |
| D. | ${\;}_{12}^{6}C$、${\;}_{6}^{13}C$、${\;}_{6}^{14}C$含有相同的中子數 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①②③④ | B. | ①②③ | C. | ①②④ | D. | ①② |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 實驗室可用丁達爾效應鑒別膠體與溶液 | |
| B. | 豆漿制豆腐是利用了膠體聚沉的原理 | |
| C. | 氫氧化鐵膠體微粒帶負電,通電時膠體微粒向直流動電源正極移動 | |
| D. | 配制氫氧化鐵膠體時,可將飽和FeCl3溶液滴入沸水中 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com