
pH=2的兩種一元酸x和y,體積均為100 mL,稀釋過程中pH與溶液體積的關系如下圖所示。分別滴加NaOH溶液(c=0.1 mol/L)至pH=7,消耗NaOH溶液的體積為Vx、Vy,則( )
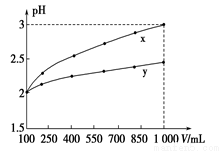
A.x為弱酸,Vx<Vy B.x為強酸,Vx>Vy
C.y為弱酸,Vx<Vy D.y為強酸,Vx>Vy
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源:2017屆安徽省江淮十校高三11月質檢化學試卷(解析版) 題型:選擇題
利用如圖所示裝置分別盛放相應物質進行下列實驗,得出結論正確的是
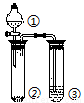
選項 | ① | ② | ③ | 判定結論 |
A | 濃硫酸 | 蔗糖 | 溴水 | 用來判定濃硫酸具有脫水性、氧化性 |
B | 稀鹽酸 | Na2SO3 | Ba(NO3)2 | 用來判定SO2與可溶性鋇鹽均可生成白色沉淀 |
C | 濃鹽酸 | Na2CO3 | Na2SiO3 | 用來判定酸性:鹽酸>碳酸>硅酸 |
D | 濃硫酸 | Cu | NaOH | 用來判定制備SO2并吸收尾氣 |
查看答案和解析>>
科目:高中化學 來源:2016-2017學年陜西省高二上期中化學卷(解析版) 題型:選擇題
下列說 法正確的是( )
法正確的是( )
A.某有機物燃燒只生成CO2和H2O,且二者物質的量相等,則 此有機物的組成為CnH2n
此有機物的組成為CnH2n
B.一種烴在足量的氧氣中燃燒并通過濃H2SO4,減少的體積就是生成的水蒸氣的體積
C.某氣態烴CxHy與足量O2恰好完全反應,如果反應前后氣體體積不變(溫度>100℃),則y=4;若體積減少,則y>4;否則y<4
D.相同質量的烴,完全燃燒,消耗O2越多,烴中含氫元素的質量分數就越高
查看答案和解析>>
科目:高中化學 來源:2016-2017學年陜西省高二上期中化學卷(解析版) 題型:選擇題
25℃時,5 mL 0.1 mol /L的 H2SO4和15 ml 0.1 mol/L的NaOH溶液相混合,并稀釋至500 ml,最后所得溶液的pH為( )
A.12.3 B.11 C.3 D.1.7
查看答案和解析>>
科目:高中化學 來源:2017屆陜西省高三上學期第三次質檢化學試卷(解析版) 題型:推斷題
現有部分短周期主族元素的性質或原子結構如下表:
元素符號 | 原子結構和元素性質 |
T | M層上有6個電子 |
W | 短周期內原子半徑最大 |
N | 原子序數比T小,且與T同主族 |
X | 最外層電子數是次外層的2倍 |
Y | 常見單質為雙原子分子且氫化物的水溶液呈堿性 |
Z | 元素最高價為+7 |
(1)元素Z在周期表中的位置 ,XN2的結構式是: ,
(2)元素X的一種核素可測定文物年代,這種核素的符號是 ;
(3)在X、Y最低價的簡單氫化物中,較穩定的化合物的分子式是 。
(4)將少量W2 N2固體投入到水中,劇烈反應,其反應的化學方程式為: 。
(5)下列表述中,能證明元素Z與元素T非金屬性的強弱的是
A、常溫下Z的單質和T的單質狀態不同
B、Z的氫化物比T的氫化物穩定
C、一定條件下Z和T的單質都能與氫氧化鈉溶液反
查看答案和解析>>
科目:高中化學 來源:2017屆陜西省高三上學期第三次質檢化學試卷(解析版) 題型:選擇題
下列措施有利于反應:N2(g)+3H2(g) 2NH3(g)△H=-92kJ•mol-1平衡
2NH3(g)△H=-92kJ•mol-1平衡 向正反應方向移動的是
向正反應方向移動的是
①升高溫度 ②降低溫度 ③增大壓強 ④減小壓強 ⑤增大NH3濃度 ⑥減小NH3濃度
A.②④⑥ B.①③⑥ C.②③⑤ D.② ③⑥
③⑥
查看答案和解析>>
科目:高中化學 來源:2017屆陜西省高三上學期第三次質檢化學試卷(解析版) 題型:選擇題
下列物質放置在空氣中,不是因發生氧化還原反應而發生變質的是
A.Na2SO3 B.Na2O2 C.NaOH D.FeSO4
查看答案和解析>>
科目:高中化學 來源:2017屆山東省日照市高三上學期期中化學試卷(解析版) 題型:選擇題
下列關于離子共存或離子反應的說法正確的是( )
A.某無色溶液中可能大量存在H+、Cl-、MnO4-、[Al(OH)4]-
B.pH=3的溶液中可能大 量存在Na+、NH4+、Fe3+、SiO32-
量存在Na+、NH4+、Fe3+、SiO32-
C.水中通入氯氣:C12+H2O=C1O-+Cl-+2H+
D.稀硫酸和氫氧化鋇溶液反應:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
查看答案和解析>>
科目:高中化學 來源:2017屆貴州省高三上模擬四化學卷(解析版) 題型:填空題
甲醇既可用于基本有機原料,又可作為燃料用于替代礦物燃料。
(1)以下是工業上合成甲醇的兩個反應:
反應I: CO(g)+2H2(g)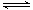 CH3OH(g) ΔH1
CH3OH(g) ΔH1
反應II:CO2(g)+3H2(g)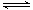 CH3OH(g)+ H2O(g) ΔH2
CH3OH(g)+ H2O(g) ΔH2
① 上述反應符合“原子經濟”原則的是 (填“I”或“II”)。
② 下表所列數據是反應I在不同溫度下的化學平衡常數(K)。
溫度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
由表中數據判斷反應I為______________熱反應(填“吸”或“放”)。
③ 某溫度下,將2 mol CO和6 mol H2充入2L的密閉容器中,充分反應,達到平衡后,測得c(CO)= 0.2 mol/L,則CO的轉化率為 ,此時的溫度為 (從表中選擇)。
(2) 已知在常溫常壓下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH1 kJ/mol
②2CO(g)+O2(g)=2CO2(g) ΔH2 kJ/mol
③H2O(g)=H2O(l) ΔH3 kJ/mol
則反應 CH3OH(l)+ O2(g)= CO(g)+ 2H2O(l) ΔH= kJ/mol
(3)現以甲醇燃料電池,采用電解法來處理酸性含鉻廢水(主要含有Cr2O72?)時,實驗室利用下圖裝置模擬該法:
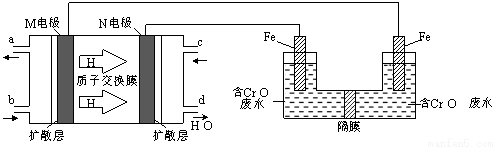
① N電極的電極反應式為 。
② 請完成電解池中Cr2O72?轉化為Cr3+的離子反應方程式:
Cr2O7 2?+ Fe2+ + [ ] ═ Cr3++ Fe3++ [ ]
(4) 處理廢水時,最后Cr3+以Cr(OH)3形式除去,當c(Cr3+)=1×10?5 mol•L﹣1 時,Cr3+沉淀完全,此時溶液的pH= 。 (已知, Ksp[Cr(OH)3]=6.4×10?31,lg2=0.3)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com