
分析 鎂鋁合金與鹽酸發生反應的化學方程式為:Mg+2HCl=MgCl2+H2↑,2Al+6HCl=2AlCl3+3H2↑,生成氫氣的物質的量為:n(H2)=$\frac{5.6L}{22.4L/mol}$=0.25mol,結合反應的方程式列方程式計算出鹽酸的物質的量濃度、合金中鋁的質量分數.
解答 解:標況下5.6L氫氣的物質的量為0.25mol,設5.1g鎂鋁合金中含有鎂xmol,含有鋁ymol,則
Mg+2HCl=MgCl2+H2↑,
1 2 1
x 2x x
2Al+6HCl=2AlCl3+3H2↑,
2 6 3
y 3y $\frac{3}{2}$y
$\left\{\begin{array}{l}{x+\frac{3}{2}y=0.25}\\{24x+27y=5.1}\end{array}\right.$
解得:$\left\{\begin{array}{l}{x=0.1}\\{y=0.1}\end{array}\right.$
(1)反應消耗的鹽酸的總物質的量為:0.1mol×2+0.1mol×3=0.5mol,
鹽酸的物質的量濃度為:c(HCl)=$\frac{0.5mol}{0.1L}$=5mol/L,
答:該鹽酸的物質的量濃度為5mol/L;
(2)該合金中鋁的質量分數為:w(Al)=$\frac{27g/mol×0.1mol}{5.1g}$×100%≈52.9%,
故:該合金中鋁的質量分數為52.9%.
點評 本題考查了有關混合物的計算,題目難度中等,注意掌握金屬鎂、鋁與酸反應的化學方程式,能夠根據題中數據計算出合金中各組分含量,試題培養了學生的分析、理解能力及計算能力.


科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 時間/min 濃度/(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 2.0 | 1.16 | 0.80 | 0.80 | 0.96 | 0.96 |
| N2 | 0 | 0.42 | 0.60 | 0.60 | 0.72 | 0.72 |
| CO2 | 0 | 0.42 | 0.60 | 0.60 | 0.72 | 0.72 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
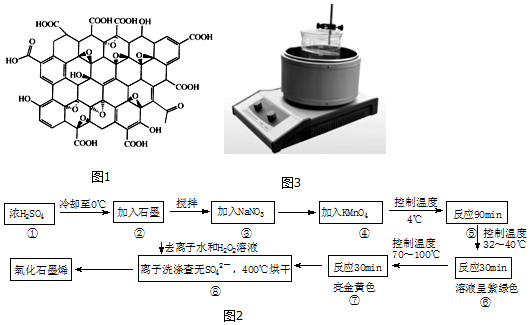
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氧化性強弱順序為XO42->Z2>R2>M3+ | |
| B. | Z2在③中發生氧化反應 | |
| C. | R元素在反應②中被氧化,在③中被還原 | |
| D. | 常溫下反應不可進行2M2++Z2═2M3++2Z- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 干冰、液態氯化氫都是電解質 | |
| B. | 根據是否具有丁達爾效應,將分散系分為溶液、濁液和膠體 | |
| C. | NaOH晶體中既含有離子鍵又含有共價鍵 | |
| D. | Na2O、Fe2O3、Al2O3既屬于堿性氧化物,又屬于離子化合物 |
查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
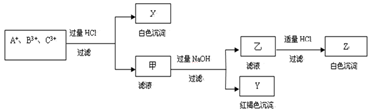
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
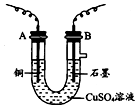 某化學興趣小組用如圖裝置電解CuSO4溶液,測定銅的相對原子質量.
某化學興趣小組用如圖裝置電解CuSO4溶液,測定銅的相對原子質量.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 水和四氯化碳可以用分液漏斗進行分離 | |
| B. | 提取溴水中的溴單質,可以用四氯化碳進行萃取 | |
| C. | 可以用高溫加熱的方法除去CaO中混有的CaCO3 | |
| D. | 可以用蒸發結晶的方法除去KNO3固體中混有的少量NaCl |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com