
將5.5 g鐵鋁混合物粉末加入900mL 1.00 mol/L HNO3溶液中,充分反應后,得a L(標準狀況)NO氣體。
(1)HNO3是否過量___________。
(2)若a=3.36L(標準狀況),則混合物中鋁的質量分數為_________%。
(3)若a=3.36L(標準狀況),往反應后的溶液中加入___________ mL 1.000 mol/L NaOH溶液時生成的沉淀量最大,還要加________ mL 1.000 mol/L NaOH溶液才能使沉淀的量保持不變。
(1)是
(2)49.09%
(3)750 100
解析試題分析:(1)鐵與等質量的鋁與硝酸反應,鋁消耗硝酸多,若5.5g固體全部是鋁,則Al~4HNO3,n(Al)=5.5/27mol,n(HNO3)=0.9mol>4n(Al),所以硝酸過量;
(2)若a=3.36L,NO的物質的量為0.15mol,設鋁的物質的量為x,根據得失電子守恒,有3x+(5.5-27x)/56×3=0.15×3,解得x=0.1mol,所以混合物中鋁的質量分數為0.1mol×27g/mol/5.5g×100%=49.09%
(3)沉淀量最大時,溶液恰為硝酸鈉的溶液,所以n(NaNO3)= n(HNO3)-n(NO)=0.9mol-0.15mol=0.75mol,根據鈉元素守恒,需1.000 mol/L NaOH溶液的體積是750mL;由(2)知生成氫氧化鋁的物質的量為0.1mol,當氫氧化鋁全部溶解時沉淀量不再改變。根據Al(OH)3~OH-所以還需0.1mol氫氧化鈉,其體積為100mL。
考點:考查混合物的計算,得失電子守恒、元素守恒規律的應用


科目:高中化學 來源: 題型:填空題
(13分)某研究性學習小組利用廢舊鉛蓄電池陰、陽極填充物------鉛膏(含PbO、PbO2、PbSO4)制備電絕緣材料三鹽基硫酸鉛(3PbO?PbSO4?H2O),進行資源回收研究,設計實驗流程如下: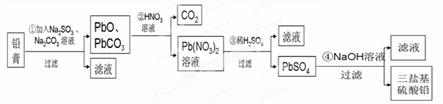
(1)步驟①鉛膏中PbSO4與Na2CO3溶液反應轉化為PbCO3,說明溶解度:PbSO4 (填“>”或“<”)PbCO3。
(2)步驟①中PbO2轉化為PbCO3的離子方程式是(請配平此離子方程式):
(3)將步驟①和④的濾液合并,加入 PH=7,再經過 、冷卻結晶、
、洗滌、干燥,可獲得Na2SO4?10H2O晶體。
(4)若鉛膏的質量為78g,步驟①中PbO2和PbSO4全部轉化為PbCO3,且PbO未發生反應;步驟②中共收集到5.6LCO2(標準狀態),步驟③中獲得90.9 g PbSO4,則鉛膏中PbO的質量分數為 (假設流程中原料無損失)。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
利用I2O5可消除CO污染或定量測定CO,反應為:5CO(g)+I2O5(s) 5CO2(g)+I2(s);ΔH 1
5CO2(g)+I2(s);ΔH 1
(1)已知:2CO(g)+O2(g) 2CO2(g);ΔH 2
2CO2(g);ΔH 2
2I2(s)+5O2(g) 2I2O5(s);ΔH 3
2I2O5(s);ΔH 3
則ΔH 1= (用含ΔH 2和ΔH 3的代數式表示)。
(2)不同溫度下,向裝有足量I2O5固體的2 L恒容密閉容器中通入2molCO,測得CO2的體積分數φ(CO2)隨時間t變化曲線如圖。請回答:
①從反應開始至a點時的反應速率為v(CO)= ,b點時化學平衡常數Kb= 。
②d點時,溫度不變,若將容器體積壓縮至原來的一半,請在圖中補充畫出CO2體積分數的變化曲線。
③下列說法正確的是 。(填字母序號)
| A.容器內氣體密度不變,表明反應達到平衡狀態 |
| B.兩種溫度下,c點時體系中混合氣體的平均相對分子質量相等 |
| C.增加I2O5的投料量有利于提高CO的轉化率 |
| D.b點和d點的化學平衡常數:Kb<Kd |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
有M、R、Q、V、W、X、Y、Z八種物質,它們之間存在如下關系:
①M+Y R ②R+H2O→NaOH+Y ③Q+NaOH→V+W+H2O ④X
R ②R+H2O→NaOH+Y ③Q+NaOH→V+W+H2O ④X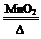 W+Y
W+Y
⑤X+W+H2SO4 Q+Z+H2O。其中M、Q、Y是單質,Q、Y在常溫、常壓下為氣體,Z是硫酸鹽,鈉、鉀化合物性質相似。
Q+Z+H2O。其中M、Q、Y是單質,Q、Y在常溫、常壓下為氣體,Z是硫酸鹽,鈉、鉀化合物性質相似。
回答下列問題:
(1)寫出各代號的化學式(或分子式) M , R ,Q ,V ,W ,X ,Y ,Z 。
(2)寫出下列有關化學反應的方程式和離子方程式,并標出電子轉移方向和總數
反應③ , ;
反應⑤ , 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
化學實驗的微型化可有效減少污染,實現化學實驗綠色化的要求。某學生按下列操作做一個實驗:在一塊下襯白紙的玻璃片的不同位置分別滴加濃度為0.1 mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每種液滴彼此分開,圍成半徑小于表面皿的圓形(如圖所示),在圓心處放置2粒芝麻粒大小的KMnO4晶體,向KMnO4晶體中滴加一滴濃鹽酸,再立即將表面皿蓋好。[已知:2KMnO4+16HCl(濃)=2KCl+2MnCl2+5Cl2↑+8H2O]
(1)e處反應的離子方程式為 ,該反應中發生反應的氧化劑和還原劑的物質的量之比為 。
(2)b處的實驗現象為 ,d處的實驗現象為 。
(3)c處反應的化學方程式為 ,標準狀況下,當有0.224 L Cl2被NaOH溶液吸收后,轉移電子的物質的量為 mol。
(4)通過該實驗能否比較Cl2、FeCl3、KMnO4三種物質氧化性的強弱? (填“能”或“不能”),若能,其氧化性由強到弱的順序是 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
Ⅰ.2013年霧霾天氣多次肆虐我國中東部地區。其中,汽車尾氣和燃煤尾氣是造成空氣污染的原因之一。汽車尾氣凈化的主要原理為:2NO(g)+2CO(g)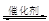 2CO2(g) +N2(g),在密閉容器中發生該反應時,c(CO2)隨溫度(T)、催化劑的表面積(S)和時間(t)的變化曲線,如下圖所示。
2CO2(g) +N2(g),在密閉容器中發生該反應時,c(CO2)隨溫度(T)、催化劑的表面積(S)和時間(t)的變化曲線,如下圖所示。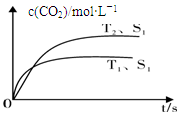
據此判斷:
(1)該反應的ΔH 0(選填“>”、“<”)。
(2)若在一定溫度下,將1.0 mol NO、0.5 mol CO充入0.5 L固定容積的容器中,達到平衡時NO、CO、CO2、N2物質的量分別為:0.8 mol、0.3 mol、0.2 mol、0.1 mol,該反應的化學平衡常數為K= ;若保持溫度不變,再向容器中充入CO、N2各0.3 mol,平衡將 移動(選填“向左”、“向右”或“不”)。
Ⅱ.以甲烷為燃料的新型電池,其成本大大低于以氫氣為燃料的傳統燃料電池,目前得到廣泛的研究,下圖是目前研究較多的一類固體氧化物燃料電池工作原理示意圖。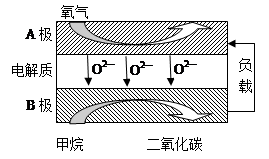
回答下列問題:
(1)B極為電池 極,電極反應式為 。
(2)若用該燃料電池做電源,用石墨做電極電解100 mL 1 mol/L的硫酸銅溶液,當兩極收集到的氣體體積相等時,理論上消耗的甲烷的體積為 (標況下)。
Ⅲ.FeS飽和溶液中存在:FeS(s) Fe2+(aq)+S2-(aq),Ksp=c(Fe2+)·c(S2-),常溫下Ksp=1.0×10-16。又知FeS飽和溶液中c(H+)與c(S2-)之間存在以下限量關系:[c(H+)]2·c(S2-)=1.0×10-22,為了使溶液中c(Fe2+)達到1 mol/L,現將適量FeS投入其飽和溶液中,應調節溶液中的pH為 。
Fe2+(aq)+S2-(aq),Ksp=c(Fe2+)·c(S2-),常溫下Ksp=1.0×10-16。又知FeS飽和溶液中c(H+)與c(S2-)之間存在以下限量關系:[c(H+)]2·c(S2-)=1.0×10-22,為了使溶液中c(Fe2+)達到1 mol/L,現將適量FeS投入其飽和溶液中,應調節溶液中的pH為 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
化學在環境保護中起著十分重要的作用。催化反硝化法和電化學降解法可用于治理水中硝酸鹽的污染。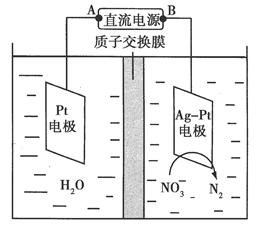
(1)催化反硝化法中,H2能將NO3-還原為N2。25℃時,反應進行10 min,溶液的pH由7變為12。
①N2的結構式為________。
②上述反應離子方程式為____________________,其平均反應速率v(NO3-)為________mol·L-1·min-1。
③還原過程中可生成中間產物NO2-,寫出3種促進NO2-水解的方法________。
(2)電化學降解NO3-的原理如圖所示。
①電源正極為________(填“A”或“B”),陰極反應式為______________。
②若電解過程中轉移了2 mol電子,則膜兩側電解液的質量變化差(Δm左-Δm右)為________g。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
Ⅰ.在一體積為10 L的容器中,通入一定量的CO和H2O,在850℃時發生如下反應:CO(g)+H2O(g) CO2(g)+H2(g) ΔH<0,CO和H2O濃度變化如圖所示:
CO2(g)+H2(g) ΔH<0,CO和H2O濃度變化如圖所示:
(1)0~4 min的平均反應速率v(CO)=________mol/(L·min),反應在第5 min時的平衡常數K=________。
t℃時物質濃度(mol/L)的變化
| 時間(min) | CO | H2O | CO2 | H2 |
| 0 | 0. 200 | 0. 300 | 0 | 0 |
| 2 | 0. 138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0. 116 | 0. 216 | 0. 084 | |
| 6 | 0. 096 | 0. 266 | 0. 104 | |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
歐盟原定于2012年1月1日起征收航空碳排稅以應對冰川融化和全球變暖,使得對如何降低大氣中CO2的含量及有效地開發利用碳資源的研究顯得更加緊迫。請運用化學反應原理的相關知識研究碳及其化合物的性質。
(1)用電弧法合成的儲氫納米碳管常伴有大量的碳納米顆粒(雜質),這種顆粒可用如下氧化法提純,請完成該反應的化學方程式: 
(2)焦炭可用于制取水煤氣。測得12 g 碳與水蒸氣完全反應生成水煤氣時,吸收了131.6 kJ熱量。該反應的熱化學方程式為 。
(3)活性炭可處理大氣污染物NO。在2 L密閉容器中加入NO和活性炭(無雜質),生成氣體E和F。當溫度分別在T1和T2時,測得各物質平衡時物質的量如下表: 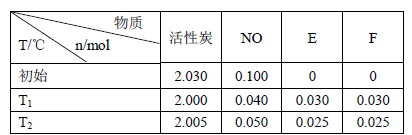
上述反應T1℃時的平衡常數為K1,T2℃時的平衡常數為K2。
Ⅰ.計算K1= 。
Ⅱ.根據上述信息判斷,溫度T1和T2的關系是(填序號) 。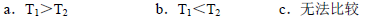
(4)CO2經常用氫氧化鈉來吸收,現有0.4 molCO2,若用200ml 3mol/LNaOH溶液將其完全吸收,溶液中離子濃度由大到小的順序為: 。
(5)CO還可以用做燃料電池的燃料,某熔融鹽燃料電池具有高的發電效率,因而受到重視,該電池用Li2CO3和 Na2CO3的熔融鹽混合物作電解質,CO為負極燃氣,空氣與CO2的混和氣為正極助燃氣,制得在 650 ℃下工作的燃料電池,其負極反應式: 則
則
正極反應式:___ ,電池總反應式 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com