
(13分)某研究性學習小組利用廢舊鉛蓄電池陰、陽極填充物------鉛膏(含PbO、PbO2、PbSO4)制備電絕緣材料三鹽基硫酸鉛(3PbO?PbSO4?H2O),進行資源回收研究,設計實驗流程如下: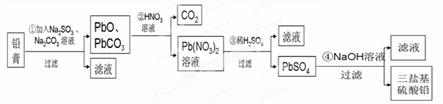
(1)步驟①鉛膏中PbSO4與Na2CO3溶液反應轉化為PbCO3,說明溶解度:PbSO4 (填“>”或“<”)PbCO3。
(2)步驟①中PbO2轉化為PbCO3的離子方程式是(請配平此離子方程式):
(3)將步驟①和④的濾液合并,加入 PH=7,再經過 、冷卻結晶、
、洗滌、干燥,可獲得Na2SO4?10H2O晶體。
(4)若鉛膏的質量為78g,步驟①中PbO2和PbSO4全部轉化為PbCO3,且PbO未發生反應;步驟②中共收集到5.6LCO2(標準狀態),步驟③中獲得90.9 g PbSO4,則鉛膏中PbO的質量分數為 (假設流程中原料無損失)。
(1)>;(2)1,1,1,1,H2O,1,1,2;(3)H2SO4;蒸發濃縮;過濾;(4)14.3%。
解析試題分析:(1)步驟①鉛膏中PbSO4與Na2CO3溶液反應轉化為PbCO3,說明PbSO4的溶解度大于PbCO3;(2)在步驟①中PbO2轉化為PbCO3的反應是氧化還原反應,所以根據電荷守恒、原子守恒可得離子方程式是PbO2+SO32-+CO32-+H2O= PbCO3↓+SO42-+2OH-。(3)將步驟①和④的濾液合并,加入H2SO4調整溶液的酸堿性PH=7,再經過蒸發濃縮;冷卻結晶、過濾,洗滌、干燥,可獲得Na2SO4?10H2O晶體。(4)若鉛膏的質量為78g,步驟①中PbO2和PbSO4全部轉化為PbCO3,且PbO未發生反應;步驟②中共收集到5.6LCO2(標準狀態),則根據Pb守恒可知PbO2和PbSO4的物質的量是5.6L÷22.4L/mol=0.25mol步驟③中獲得90.9 g PbSO4,n(PbSO4)=" 90.9" g÷303g/mol=0.3mol,其中由PbO產生的PbSO4是物質的量是0.3mol-0.25mol=0.05mol則鉛膏中PbO的質量分數為(0.05mol×223g/mol÷78g)×100%=14.3%。
考點:考查物質的制取過程中的反應原理的知識。包括物質的溶解度大小的比較、離子方程式的配平、混合物的分離方法、物質純度的計算等知識。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:單選題
三聚氰酸[C3N3(OH)3]可用于消除汽車尾氣中的NO2。其反應原理為:
C3N3(OH)3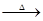 3HNCO;8HNCO+6NO2
3HNCO;8HNCO+6NO2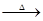 7N2+8CO+4H2O。
7N2+8CO+4H2O。
下列說法止確的是
| A.C3N3(OH)3與HNCO為同一物質 | B.1mol HNCO與NO2反應時轉移3mol電子 |
| C.HNCO是強氧化劑 | D.反應中CO2是氧化產物 |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
氨氧化制硝酸的反應如下(未配平):①NH3 + O2 →NO + H2O ②NO + O2 → NO2
③NO2+H2O→HNO3+NO,如將氨全部氧化得2mol硝酸,理論上需氧氣的物質的量是( )
| A.2mol | B.3 mol | C.4 mol | D.5 mol |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(1 5分)
世界環保聯盟建議全面禁止使用氯氣用于飲用水的消毒,而建議采用高效“綠色”消毒劑二氧化氯。二氧化氯是一種極易爆炸的強氧化性氣體,易溶于水、不穩定、呈黃綠色,在生產和使用時必須盡量用稀有氣體進行稀釋,同時需要避免光照、震動或受熱。實驗室以電解法制備ClO2的流程如下: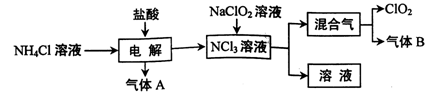
(1)ClO2中所有原子 (填“是”或“不是”)都滿足8電子結構。上圖所示方法制得的混合氣中雜質氣體B能使石蕊試液顯藍色,除去該雜質氣體可選用 __;
A.飽和食鹽水 B.堿石灰 C.濃硫酸 D.蒸餾水
(2)穩定性二氧化氯是為推廣二氧化氯而開發的新型產品。下列說法正確的是 ;
A.二氧化氯可廣泛用于工業和飲用水處理
B.應用在食品工業中能有效地延長食品貯藏期
C.穩定性二氧化氯的出現大大增加了二氧化氯的使用范圍
D.在工作區和成品儲藏室內,要有通風裝置和監測及警報裝置
(3)歐洲國家主要采用氯酸鈉氧化濃鹽酸制備,但該方法缺點是產率低、產品難以分離,還可能污染環境。寫出該方法發生的化學方程式 ;
(4)我國廣泛采用經干燥空氣稀釋的氯氣與固體亞氯酸鈉(NaClO2)反應制備,化學方程式是
,此法相比歐洲方法的優點是 。
(5)科學家又研究出了一種新的制備方法,利用硫酸酸化的草酸(H2C2O4)溶液還原氯酸鈉,化學反應方程式為 ,此法提高了生產及儲存、運輸的安全性,原因是____ 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(8分)二氧化硒(SeO2)是一種氧化劑,其被還原后的單質硒可能成為環境污染物,通過與濃HNO3或濃H2SO4反應生成SeO2以回收Se。完成下列填空:
(1)Se和濃HNO3反應的還原產物為NO和NO2,且NO和NO2的物質的量之比為1:1,寫出Se和濃HNO3的反應方程式
(2)已知:Se+2H2SO4(濃) = 2SO2↑+SeO2+2H2O 2SO2+SeO2+2H2O = Se+2SO42-+4H+
SeO2、H2SO4(濃)、SO2的氧化性由強到弱的順序是
(3)回收得到的SeO2的含量,可以通過下面的方法測定:
①SeO2+KI+HNO3→Se+I2+KNO3+H2O ②I2+2Na2S2O3 = Na2S4O6+2NaI
配平方程式①,標出電子轉移的方向和數目
(4)實驗中,準確稱量SeO2樣品0.1500g,消耗了0.2000 mol/L的Na2S2O3溶液25.00 mL,所測定的樣品中SeO2的質量分數為
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(本題16分)鉬酸鈉晶體(Na2MoO4·2H2O)是無公害型冷卻水系統的金屬緩蝕劑,由鉬精礦(主要成分是MoS2,含少量PbS等)制備鉬酸鈉晶體的部分流程如下: (1)焙燒的過程中采用的是“逆流焙燒”的措施,則該措施的優點是:①_______________
(1)焙燒的過程中采用的是“逆流焙燒”的措施,則該措施的優點是:①_______________
②____________________________
(2)寫出焙燒時生成MoO3的化學方程式為:______________________________________
(3)寫出“堿浸”反應的離子方程式:
(4)重結晶得到的母液可以在下次重結晶時重復使用,但達到一定次數后必須凈化處理,原因是 。
(5)下圖是碳鋼在3種不同介質中的腐蝕速率實驗結果: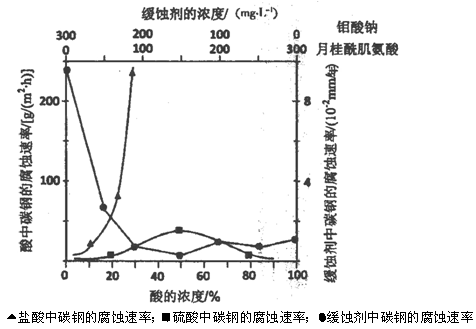
①碳鋼在鹽酸和硫酸中腐蝕速率隨酸的濃度變化有明顯差異,其原因可能是 ________________。
②空氣中鉬酸鹽對碳鋼的緩蝕原理是在鋼鐵表面形成FeMoO4—Fe2O3保護膜。
密閉式循環冷卻水系統中的碳鋼管道緩蝕,除需加入鉬酸鹽外還需加入NaNO2。則NaNO2的作用是 _________________________________________。
③若緩釋劑鉬酸鈉—月桂酸肌氨酸總濃度為300mg·L-1,則緩蝕效果最好時鉬酸鈉的物質的量濃度為
(6)鋰和二硫化鉬形成的二次電池的總反應為:xLi + nMoS2 Lix(MoS2)n。則電池放電時的正極反應式是:___________________________________。
Lix(MoS2)n。則電池放電時的正極反應式是:___________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
已知銅和濃硫酸可以在加熱條件下發生如下反應(反應方程式已配平):
Cu+2H2SO4(濃)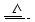 CuSO4+A↑+2H2O
CuSO4+A↑+2H2O
試通過計算和推理完成下面的問題:
(1)A物質可以導致酸雨的形成。則A應該屬于 (用字母代號填寫)
A.酸 B.堿 C.鹽 D.酸性氧化物 E.堿性氧化物
A物質可以使酸性KMnO4溶液褪色,此反應中 (填寫化學式,下同)失去電子,氧化劑是 。
(2)若A物質通入品紅溶液,觀察到溶液褪色,說明A物質具有 (填序號,下同);若A物質通入Na2S溶液,觀察到溶液中出現淡黃色渾濁,說明SO2具有 。
A.氧化性 B.還原性 C.漂白性
若A物質通入雙氧水,請大膽判斷所得溶液是 (填溶質的化學式)
(3)一定量的銅片與100mL 18mol/L 的濃H2SO4充分反應,如果該反應過程中轉移了0.2mol電子,生成的A氣體在標準狀況下體積為 L (假設氣體全部逸出)。若用4 mol·L-1的NaOH溶液吸收生成的A,并生成正鹽,寫出發生的反應方程式 計算需要NaOH溶液的體積 L。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
請將5種物質:N2O、FeCl2、Fe(NO3)3、HNO3和FeCl3分別填入下面對應的橫線上,組成一個未配平的化學方程式。
(1) + → + + +H2O(不需配平)
(2)反應過程中,N2O與FeCl2的物質的量之比為 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
將5.5 g鐵鋁混合物粉末加入900mL 1.00 mol/L HNO3溶液中,充分反應后,得a L(標準狀況)NO氣體。
(1)HNO3是否過量___________。
(2)若a=3.36L(標準狀況),則混合物中鋁的質量分數為_________%。
(3)若a=3.36L(標準狀況),往反應后的溶液中加入___________ mL 1.000 mol/L NaOH溶液時生成的沉淀量最大,還要加________ mL 1.000 mol/L NaOH溶液才能使沉淀的量保持不變。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com