
【題目】下列各表述與示意圖一致的是
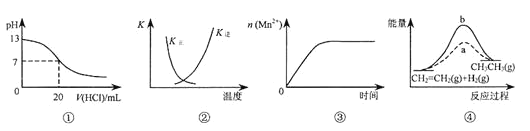
A. 圖①表示25℃時,用0.1 mol·L-1鹽酸滴定20 mL 0.1 mol·L-1NaOH溶液,溶液的pH隨加入酸體積的變化
B. 圖②中曲線表示反應2SO2(g) + O2(g)![]() 2SO3(g);ΔH < 0 正、逆反應的平衡常數K隨溫度的變化
2SO3(g);ΔH < 0 正、逆反應的平衡常數K隨溫度的變化
C. 圖③表示10 mL 0.01 mol·L-1KMnO4酸性溶液與過量的0.1 mol·L-1H2C2O4溶液混合時,n(Mn2+) 隨時間的變化
D. 圖④中a、b曲線分別表示反應CH2=CH2(g) + H2(g)![]() CH3CH3(g);ΔH< 0使用和未使用催化劑時,反應過程中的能量變化
CH3CH3(g);ΔH< 0使用和未使用催化劑時,反應過程中的能量變化
科目:高中化學 來源: 題型:
【題目】實驗室可用如圖裝置制得氯氣并與鋁粉反應制備無水AlCl3。已知AlCl3在183°C升華,遇潮濕空氣即反應產生大量白霧。請回答問題:
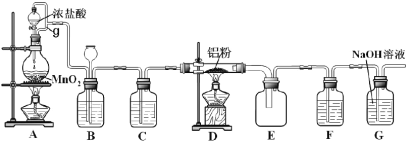
(1)A中反應的化學方程式為_________;HCl在反應中表現出的性質為______(填:酸性、氧化性或還原性)。
(2)A中g管的作用是________。
(3)B中盛放飽和食鹽水的作用是________;若D中生成的AlCl3凝華堵塞導管,B中可觀察到的現象為________。
(4)C和F所裝試劑相同,其中F的作用是___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一水硫酸錳(MnSO4H2O)是一種重要的化工中間體,工業上可由高鐵菱錳礦(主要成分為MnCO3,含有FeCO3、Al2O3、MgO、CaO、SiO2等雜質)制備,部分工藝流程如下:
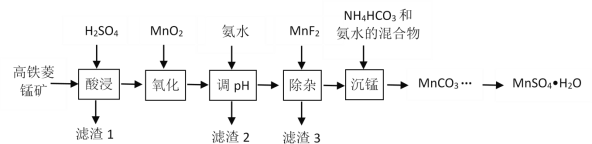
相關金屬離子[c(Mn+)=0.1 mol·L1]形成氫氧化物沉淀的 pH范圍如下:
金屬離子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ |
開始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 |
(1)“酸浸”時高鐵菱錳礦需要粉碎,并進行充分攪拌,為提高錳的浸出率還可采取的措施有_________。(寫出其中一種)
(2)“氧化”時發生反應的化學方程式為________。
(3)“調pH”范圍至5~6,得到濾渣2的主要成分除MnO2外還有_________。
(4)“除雜”過程中加入MnF2的目的是_________。已知:Ksp(MgF2)=5.16×10-11,Ksp(CaF2)=5.3×10-9。
(5)“沉錳”過程中發生反應的離子方程式為_________。
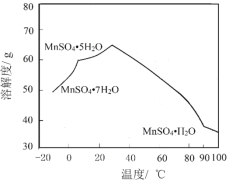
(6)MnSO4在水中的溶解度與溫度關系如圖。由MnCO3獲得較純凈的MnSO4H2O 晶體的方法是:將MnCO3溶于_________,控制溫度為_________以上結晶,得到MnSO4H2O晶體,洗滌、烘干。晶體烘干時溫度不能過高的原因是_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是
A. 向50mL 1mol·L-1的鹽酸中加入燒堿,水的KW不變
B. NH4Cl和NH3·H2O混合液中,二者對對方的平衡都起了抑制作用
C. 有兩種弱酸HX和HY且酸性HX>HY,則體積和濃度相同的NaX和NaY溶液中有c(Y-)>c(X-)>c(OH-)>c(H+)
D. 常溫0.1mol·L-1HA溶液中c(OH-)/ c(H+)=10-8,則0.01mol·L-1 HA溶液中c(H+)=1×10-4mol·L-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】由重水D2O組成的水,D2O的離子積為1.6×10-15,可用pH一樣定義規定pD= -lg{c(D+)},下列關于pD的敘述,正確的是( )
A. D2O呈中性,pD=7
B. 含0.01mol NaOD的D2O溶液1L,pD=12
C. 用D2O溶解0.1mol DCl成1L溶液,pD=2
D. 在100mL 0.25mol/L DCl溶液中加入50mL 0.2mol/L的NaOD的D2O溶液,pD=1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】研究CO2的利用對促進低碳社會的構建具有重要的意義。
(1)現有反應:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH<0。在850℃時,K=1。
CH3OH(g)+H2O(g) ΔH<0。在850℃時,K=1。
①如果上述反應的平衡常數K值變大,該反應___(填字母)。
a.一定向正反應方向移動 b.在平衡移動過程中正反應速率先增大后減小
c.一定向逆反應方向移動 d.在平衡移動過程中逆反應速率先減小后增大
②若反應容器的容積為2.0L,反應時間4.0min,容器內氣體的物質的量減小了0.8mol,在這段時間內CO2的平均反應速率為___。
③在850℃時,若向1L的密閉容器中同時充入3.0mol CO2、1.0molH2、1.0molCH3OH、5.0molH2O(g),上述反應向___(填“正反應”或“逆反應”)方向進行。
(2)以二氧化鈦表面覆蓋Cu2Al2O4為催化劑,可以將CO2和CH4直接轉化成乙酸。
①在不同溫度下催化劑的催化效率與乙酸的生成速率如圖所示。250~300℃時,溫度升高而乙酸的生成速率降低的原因是___。
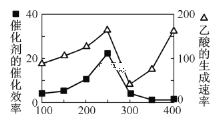
②為了提高該反應中CO2的轉化率,可以采取的措施是___。(寫一條即可)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA為阿伏伽德羅常數的數值,下列說法正確的是( )
A.7.2g CaO2固體中陰陽離子總數為0.3NA
B.密閉容器中2 mol NO與1mol O2充分反應,產物的分子數目為2NA
C.在一定條件下,6.4g銅與過量的硫反應,轉移的電子數目為0.2NA
D.10g質量分數為46%的乙醇溶液中O-H鍵數目為0.7NA
查看答案和解析>>
科目:高中化學 來源: 題型:
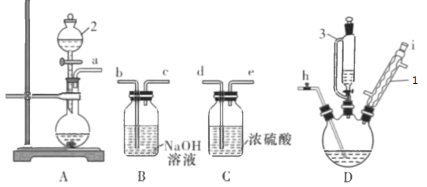
【題目】三氯氧磷(POCl3)可用于制備增塑劑,常溫下為無色透明液體,密度1.68g/mL,沸點105.8oC,易揮發,易水解。一中化學興趣小組探究制備POCl3所需的裝置如下圖所示:
反應原理:![]() (PC13常溫下為液態,密度1.57g/mL,沸點75oC,易揮發,易水解)。
(PC13常溫下為液態,密度1.57g/mL,沸點75oC,易揮發,易水解)。
(1)儀器3的名稱是 ________,儀器2中裝入的物質為_______,儀器1的作用是 ___________。
(2)A中發生的反應的離子方程式可能為__________________________________
(3)請組裝好上述裝置(如有必要可以重復選擇),用小寫字母連接:_________________。
(4)開始通入氯氣,同時慢慢滴加水,控制氯氣和水的質量比大于等于3.94,理由是_____________________________________。
(5)準確量取13.75mL PCl3充分反應后經分離提純得到純凈的POCl3 16.8g,請計算實驗的產率為________________________ .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列是鹵素單質(F2、Cl2、Br2、I2)的沸點與相對分子質量的關系圖,下列說法錯誤的是

A. 單質①是最活潑的非金屬單質
B. 單質②能使品紅溶液褪色
C. 保存少量的單質③時加少量水進行水封
D. 單質④的氫化物在鹵素氫化物中沸點最高
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com