
【題目】(1)現有下列10種物質:①O2;②H2;③NH4NO3;④Na2O2;⑤Ba(OH)2;⑥CH4;⑦CO2;⑧NaF;⑨NH3;⑩I2。其中既含離子鍵又含非極性鍵的是________(填序號,下同);既含離子鍵又含極性鍵的是________;。
(2)X、Y兩種主族元素能形成XY2型化合物,已知XY2中共有38個電子。若XY2為常見元素形成的離子化合物,則其電子式為______________________________________________;若XY2為共價化合物,則其結構式為_________________________________________。
(3)氯化鋁的物理性質非常特殊,如氯化鋁的熔點為190℃,但在180℃就開始升華。據此判斷,氯化鋁是______________(填“共價化合物”或“離子化合物”),可以證明該判斷正確的實驗依據是_______________________________________。
(4)現有a~g七種短周期元素,它們在元素周期表中的位置如圖所示,請據此回答下列問題:
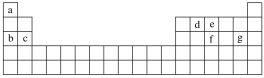
元素的原子間最容易形成離子鍵的是____(填字母,下同),容易形成共價鍵的是____。
A.c和f B.b和g C.d和g D.b和e
【答案】④ ③⑤ ![]() S=C=S 共價化合物 氯化鋁在熔融狀態下不能導電 B C
S=C=S 共價化合物 氯化鋁在熔融狀態下不能導電 B C
【解析】
(1)一般來說,活潑金屬與非金屬形成離子鍵,非金屬之間形成共價鍵,同種非金屬形成非極性鍵,不同非金屬形成極性鍵,據此分析判斷;
(2)X、Y兩種主族元素能形成XY2型化合物,已知XY2中共有38個電子,若XY2為常見元素形成的離子化合物,為CaF2;若XY2為共價化合物時,為CS2,據此分析解答;
(3)氯化鋁的熔點為190℃(2.02×103 Pa),但在180℃就開始升華,可知熔沸點低,與分子晶體的性質相似;
(4)由元素的位置可知,a為H,b為Na,c為Mg,d為出,e為N,f為P,g為Cl。根據活潑金屬與活潑非金屬容易形成離子鍵,非金屬之間容易形成共價鍵。
(1)①O2中只含共價鍵,為單質;②H2中只含共價鍵,為單質;③NH4NO3中含離子鍵和極性鍵,為離子化合物;④Na2O2中含離子鍵和非極性鍵,為離子化合物;⑤Ba(OH)2中含離子鍵和極性鍵,為離子化合物;⑥CH4中含極性鍵,為共價化合物;⑦CO2中含極性鍵,為共價化合物;⑧NaF中只含離子鍵,為離子化合物;⑨NH3中含極性鍵,為共價化合物;⑩I2中只含共價鍵,為單質;則既有離子鍵又有非極性鍵的是④;既有離子鍵又有極性鍵的是③⑤,故答案為:④;③⑤;
(2)X、Y兩種主族元素能形成XY2型化合物,已知XY2中共有38個電子,若XY2為常見元素形成的離子化合物,則XY2為CaF2,其電子式為![]() ;若XY2為共價化合物時,則XY2為CS2,其結構與二氧化碳相似,結構式為S=C=S,故答案為:
;若XY2為共價化合物時,則XY2為CS2,其結構與二氧化碳相似,結構式為S=C=S,故答案為:![]() ;S=C=S;
;S=C=S;
(3)氯化鋁的熔點為190℃(2.02×103 Pa),但在180℃就開始升華,可知熔沸點低,與分子晶體的性質相似,可知由共價鍵形成的共價化合物,可利用熔融狀態下能否導電設計實驗證明,故答案為:共價化合物;氯化鋁在熔融狀態下不能導電;
(4)由元素在元素周期表中的位置可知,a為H,b為Na,c為Mg,d為C,e為N,f為P,g為Cl。活潑的金屬和活潑的非金屬之間容易形成離子鍵,元素的原子間最容易形成離子鍵的是b和g,形成的物質為NaCl,非金屬原子間容易形成共價鍵,容易形成共價鍵的是d和g,形成的物質為CCl4,故答案為:B;C。


 新題型全程檢測期末沖刺100分系列答案
新題型全程檢測期末沖刺100分系列答案科目:高中化學 來源: 題型:
【題目】軟質隱形眼鏡材料W、樹脂X的合成路線如圖所示。
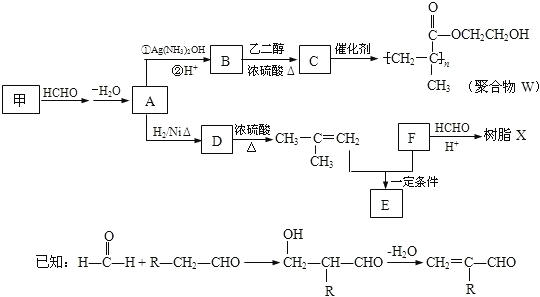
(1)A 中含有的官能團名稱是_________。
(2)甲的結構簡式是_____________。
(3)B→C反應的化學方程式是______________________________________________。
(4)B有多種同分異構體.屬于酯且含有碳碳雙鍵的同分異構體共有______種(不考慮順反異構,下同),寫出其中能發生銀鏡反應,且含有甲基的所有同分異構體的結構簡式是___________。
(5)已知F的相對分子質量為110,分子中碳原子、氫原子數都是氧原子數的3倍,苯環上的氫原子化學環境都相同.則F還能發生的反應是________(填序號)。
A.加成反應 b.氧化反應 c.加聚反應 D.水解反應
(6)寫出樹脂X可能的結構簡式___________(寫出一種即可)。
(7)E的分子式為C10H14O2,含三個甲基,苯環上的一溴代物有兩種,生成E的化學方程式是____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某同學采用硫鐵礦焙燒取硫后的燒渣(主要成分為Fe2O3、SiO2、Al2O3,不考慮其他雜質)制取七水合硫酸亞鐵(FeSO4·7H2O),設計了如下流程:

下列說法不正確的是( )
A. 溶解燒渣選用足量硫酸,試劑X選用鐵粉
B. 固體1中一定含有SiO2,控制pH是為了使Al3+轉化為Al(OH)3,進入固體2
C. 從溶液2得到FeSO4·7H2O產品的過程中,須控制條件防止其氧化和分解
D. 若改變方案,在溶液1中直接加NaOH至過量,得到的沉淀用硫酸溶解,其溶液經結晶分離也可得到FeSO4·7H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ.肼(N2H4)又稱聯氨,常溫時是一種可燃性液體,可用作火箭燃料。
①2O2(g)+N2(g)=N2O4(l) ΔH1
②N2(g)+2H2(g)=N2H4(l) ΔH2
③O2(g)+2H2(g)=2H2O(g) ΔH3
④2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) ΔH4
上述反應熱效應之間的關系式為ΔH4=___。(用ΔH1、ΔH2、ΔH3表示)
II.如圖所示,某研究性學習小組利用上述燃燒原理設計一個肼(N2H4)─空氣燃料電池(如圖甲)并探究某些工業原理,其中乙裝置中X為陽離子交換膜(即只允許陽離子通過)。
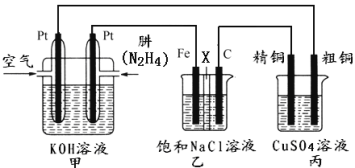
根據要求回答相關問題:
(1)甲裝置中通入___氣體的一極為正極。
(2)乙裝置中石墨電極為___極,其電極反應式為__;可以用__檢驗該反應產物,電解一段時間后,乙池中的溶液呈__性。
(3)圖中用丙裝置模擬工業中的___原理,如果電解后丙裝置精銅質量增加3.2g,則理論上甲裝置中肼消耗質量為__g。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有一塊鐵的“氧化物”樣品,用140mL 5.0mol·L-1鹽酸恰好將之完全溶解,所得溶液還能吸收0.025mol Cl2,恰好使其中的Fe2+全部轉變為Fe3+,則該樣品可能的化學式為
A. Fe2O3B. Fe3O4C. Fe4O5D. Fe5O7
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鈉、鋁和鈣是中學化學常見的三種重要金屬。請回答下列問題:
(1)常盛放在呼吸面具中作為供氧劑的物質為____________(填“![]() ”或“
”或“![]() ”)。
”)。
(2)![]() 能溶于酸或強堿溶液生成鹽和水,則
能溶于酸或強堿溶液生成鹽和水,則![]() 是一種____________(填“酸性”“堿性”或“兩性”)氧化物。
是一種____________(填“酸性”“堿性”或“兩性”)氧化物。
(3)漂白粉的有效成分為____________(填“![]() ”或“
”或“![]() ”)。
”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】回答下列問題:
(1)工業上常用鋁土礦冶煉金屬鋁。
①鋁土礦的主要成分為![]() 和
和![]() ,其中
,其中![]() 屬于____________(填“酸性”“堿性”或“兩性”)氧化物;
屬于____________(填“酸性”“堿性”或“兩性”)氧化物;
②冶煉過程中需要用到氨,氨溶于水所得溶液呈____________(填“酸性”或“堿性”);
③利用金屬活動性的不同,可以采用不同的冶煉方法,制取單質鋁應采取_____________(填“熱還原法”或“電解法”)。
(2)工業上合成氨的反應為:![]() ,一定條件下,將
,一定條件下,將![]() 和
和![]() 置于
置于![]() 的密閉容器中,
的密閉容器中,![]() 后測得
后測得![]() 為
為![]() 。
。
①用![]() 表示該反應的速率為___________;
表示該反應的速率為___________;
②其他條件不變時,再通入![]() ,該反應的速率將_____________(填“增大”或“減小”)。
,該反應的速率將_____________(填“增大”或“減小”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】把河沙(主要成分是![]() )與鎂粉按一定質量比(質量比略大于
)與鎂粉按一定質量比(質量比略大于![]() )混合均勻,裝入試管中加熱大約
)混合均勻,裝入試管中加熱大約![]() 后發生劇烈反應,生成一種白色固體化合物和一種硅化物,待生成的混合物冷卻后放入盛有稀硫酸的燒杯中,立即產生氣泡并伴有爆炸聲,產生的氣體是一種能在空氣中自燃的氣態氫化物。
后發生劇烈反應,生成一種白色固體化合物和一種硅化物,待生成的混合物冷卻后放入盛有稀硫酸的燒杯中,立即產生氣泡并伴有爆炸聲,產生的氣體是一種能在空氣中自燃的氣態氫化物。
(1)寫出河沙與鎂粉在加熱條件下發生反應的化學方程式:______。
(2)生成的混合物放入稀硫酸中,產生的氣體是______(填分子式)。
(3)用化學方程式表示產生“爆炸聲”的原因:______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NA代表阿伏加德羅常數的值。下列說法正確的是
A. 常溫常壓下,124 g P4中所含P—P鍵數目為4NA
B. 100 mL 1mol·L1FeCl3溶液中所含Fe3+的數目為0.1NA
C. 標準狀況下,11.2 L甲烷和乙烯混合物中含氫原子數目為2NA
D. 密閉容器中,2 mol SO2和1 mol O2催化反應后分子總數為2NA
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com