
分析 (1)將少量NaHSO4溶液滴加到Ba(OH)2溶液中,生成硫酸鋇、氫氧化鈉和水;
向Ca(HCO3)2溶液中滴加過量NaOH溶液生成碳酸鈣、碳酸鈉和水;
(2)NH4HCO3溶液與足量NaOH溶液反應(yīng)生成一水合氨、碳酸鈉和水;
在FeI2溶液中,滴加少量稀硝酸,碘離子被氧化為碘單質(zhì),硝酸被還原為NO;
(3)①二價鐵離子有還原性,Cr2O72-有強(qiáng)氧化性,二者能發(fā)生氧化還原反應(yīng),根據(jù)電子得失配平;
②次氯酸鈉具有強(qiáng)氧化性,可氧化I-生成單質(zhì)I2;
③Na2SO3具有還原性,可還原I2生成I-,使藍(lán)色消失;
④氧化還原反應(yīng)中,氧化劑氧化性大于氧化產(chǎn)物的氧化性.
解答 解:(1)將少量NaHSO4溶液滴加到Ba(OH)2溶液中,生成硫酸鋇、氫氧化鈉和水,所以離子方程式為:Ba2++SO42-+OH-+H+=BaSO4↓+H2O,
向Ca(HCO3)2溶液中滴加過量NaOH溶液生成碳酸鈣、碳酸鈉和水,所以離子方程式為:Ca2++2HCO3-+2OH-+=CaCO3↓+CO32-+2H2O;
故答案為:Ba2++SO42-+OH-+H+=BaSO4↓+H2O;Ca2++2HCO3-+2OH-+=CaCO3↓+CO32-+2H2O;
(2)NH4HCO3溶液與足量NaOH溶液反應(yīng)生成一水合氨、碳酸鈉和水,離子方程式為NH4++HCO3-+2OH-=NH3.H2O+CO32-+H2O;
在FeI2溶液中,滴加少量稀硝酸,碘離子被氧化為碘單質(zhì),硝酸被還原為NO,其反應(yīng)離子方程式為:6I-+2NO3-+8H+═3I2+2NO↑+4H2O;
故答案為:NH4++HCO3-+2OH-=NH3.H2O+CO32-+H2O;6I-+2NO3-+8H+═3I2+2NO↑+4H2O;
(3)①二價鐵離子有還原性,Cr2O72-有強(qiáng)氧化性,二者能發(fā)生氧化還原反應(yīng),二價鐵離子被氧化成三價鐵離子,Cr2O72-被還原為Cr3+,反應(yīng)方程式為:Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O;
故答案為:Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O;
②次氯酸鈉具有強(qiáng)氧化性,可氧化I-生成單質(zhì)I2,I2遇淀粉變藍(lán),反應(yīng)的離子方程式為ClO-+2I-+H2O═I2+Cl-+2OH-,
故答案為:ClO-+2I-+H2O═I2+Cl-+2OH-;
③Na2SO3具有還原性,可還原I2生成I-,使藍(lán)色消失,反應(yīng)的離子方程式為SO32-+I2+2OH-═SO42-+2I-+H2O,
故答案為:SO32-+I2+2OH-═SO42-+2I-+H2O;
④氧化還原反應(yīng)中,氧化劑氧化性大于氧化產(chǎn)物的氧化性,由①可知ClO->I2,由②可知I2>SO42-,
故答案為:ClO->I2>SO42-.
點(diǎn)評 本題考查了離子方程式的書寫、氧化還原反應(yīng),題目難度不大,明確發(fā)生反應(yīng)的實質(zhì)為解答關(guān)鍵,注意熟練掌握離子方程式的書寫原則,試題培養(yǎng)了學(xué)生的靈活應(yīng)用能力.



| 年級 | 高中課程 | 年級 | 初中課程 |
| 高一 | 高一免費(fèi)課程推薦! | 初一 | 初一免費(fèi)課程推薦! |
| 高二 | 高二免費(fèi)課程推薦! | 初二 | 初二免費(fèi)課程推薦! |
| 高三 | 高三免費(fèi)課程推薦! | 初三 | 初三免費(fèi)課程推薦! |
科目:高中化學(xué) 來源: 題型:實驗題
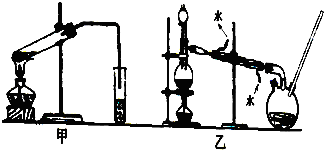
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:選擇題
| A. | 硫酸比鹽酸穩(wěn)定 | B. | 氯化氫比硫化氫穩(wěn)定 | ||
| C. | 鹽酸酸性比氫硫酸強(qiáng) | D. | 亞硫酸酸性比高氯酸弱 |
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:選擇題
| A. | 常溫常壓下,0.5molH2中含有的H原子數(shù) | |
| B. | 22.4升HCl氣體中含有的Cl原子 | |
| C. | 1L1mol/L硫酸溶液所含的H+數(shù) | |
| D. | 0.1mol金屬鋁含有的電子數(shù) |
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:選擇題
 T℃時,將6mol CO2和8mol H2充入2L密閉恒容容器中,發(fā)生反應(yīng):CO2(g)+3H2(g)?CH3OH(g)+H2O(g),容器中H2的物質(zhì)的量隨時間變化如圖中實線所示.圖中虛線表示僅改變某一反應(yīng)條件時,H2的物質(zhì)的量隨時間的變化.下列說法正確的是( )
T℃時,將6mol CO2和8mol H2充入2L密閉恒容容器中,發(fā)生反應(yīng):CO2(g)+3H2(g)?CH3OH(g)+H2O(g),容器中H2的物質(zhì)的量隨時間變化如圖中實線所示.圖中虛線表示僅改變某一反應(yīng)條件時,H2的物質(zhì)的量隨時間的變化.下列說法正確的是( )| A. | 反應(yīng)開始至a點(diǎn)時v(H2)=2 mol/(L•min) | |
| B. | 若曲線Ⅰ對應(yīng)的條件改變是升溫,則該反應(yīng)放熱反應(yīng) | |
| C. | 曲線Ⅱ?qū)?yīng)的條件改變是降低壓強(qiáng) | |
| D. | 曲線Ⅱ?qū)?yīng)的條件改變是加入催化劑 |
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:解答題
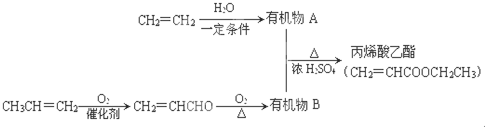
 ,丙烯酸乙酯分子中的含氧官能團(tuán)名稱是碳碳雙鍵、酯基.
,丙烯酸乙酯分子中的含氧官能團(tuán)名稱是碳碳雙鍵、酯基. .
.查看答案和解析>>
科目:高中化學(xué) 來源: 題型:選擇題
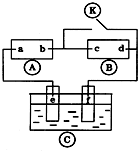 如圖
如圖 為直流電源,
為直流電源, 為浸透飽和氯化鈉溶液和酚酞試液的濾紙,
為浸透飽和氯化鈉溶液和酚酞試液的濾紙, 為電鍍槽.接通電路后發(fā)現(xiàn)
為電鍍槽.接通電路后發(fā)現(xiàn) 上的c點(diǎn)顯紅色.為實現(xiàn)鐵上鍍鋅,接通
上的c點(diǎn)顯紅色.為實現(xiàn)鐵上鍍鋅,接通 后,使c、d兩點(diǎn)短路.下列敘述正確的是( )
后,使c、d兩點(diǎn)短路.下列敘述正確的是( )| A. | a為直流電源的負(fù)極 | B. | c極發(fā)生的反應(yīng)為2H++2e-=H2↑ | ||
| C. | f電極為鋅板 | D. |  中溶液的溶質(zhì)為FeSO4 中溶液的溶質(zhì)為FeSO4 |
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:選擇題
| A. | H2和NH3 | B. | N2和O2 | C. | CO和CO2 | D. | H2S和HCl |
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:計算題
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com