
分析 (1)組裝儀器的一般順序是采用先下后上,先左后右的原則,利用本規(guī)則即可解答;
(2)加入氯化鋇溶液檢驗硫酸根離子是否除盡;
(3)由流程可知,②中加氯化鋇可除去硫酸根離子,③中加NaOH除去鎂離子,④中加碳酸鈉可除去鋇離子、鈣離子,過濾后主要為氯化鈉和碳酸鈉,⑥中加鹽酸反應(yīng)后溶液中溶質(zhì)為NaCl,然后蒸發(fā)結(jié)晶得到NaCl.
解答 解:(1)組裝儀器時要從下向上組裝,酒精燈在鐵圈和蒸發(fā)皿的下方,所以要先放酒精燈;然后再固定鐵圈,放置蒸發(fā)皿;然后再點燃酒精燈加熱,并攪拌,當有較多晶體析出時,停止加熱,利用余熱蒸干,所以正確的操作順序為:③①②④⑤,
故答案為:③①②④⑤;
(2)加入過量氯化鋇溶液除去硫酸根離子,檢驗硫酸根離子已除盡,可取少量溶液于是試管中加入鹽酸酸化的BaCl2溶液,若有白色沉淀,則證明有SO42-
;如果還有硫酸根離子沒有除盡,可以在溶液中繼續(xù)加入過量的氯化鋇,反應(yīng)的離子方程式為Ba2++SO42-═BaSO4↓,
故答案為:取少量溶液于是試管中加入鹽酸酸化的BaCl2溶液,若有白色沉淀,則證明有SO42-;加入稍微過量的BaCl2溶液;Ba2++SO42-═BaSO4↓;
(3)④中加碳酸鈉可除去鋇離子、鈣離子,發(fā)生離子反應(yīng)為Ca2++CO32-═CaCO3↓、Ba2++CO32-═BaCO3↓,故答案為:Ca2++CO32-═CaCO3↓;Ba2++CO32-═BaCO3↓;第⑥步中加入鹽酸的目的是除去過量的氫氧化鈉和碳酸鈉,
故答案為:Ca2++CO32-═CaCO3↓;Ba2++CO32-═BaCO3↓;除去過量的NaOH溶液和Na2CO3溶液.
點評 本題考查物質(zhì)分離、提純實驗方案的設(shè)計,把握粗鹽提純流程中的分離方法及發(fā)生的離子反應(yīng)為解答的關(guān)鍵,側(cè)重分析能力及物質(zhì)除雜的考查,題目難度不大.


科目:高中化學(xué) 來源: 題型:選擇題
| A. | $\frac{1000wd}{M(w+1000)}$ mol•L-1 | B. | $\frac{wd}{Mw+1000}$mol•L-1 | ||
| C. | $\frac{w}{M}$mol•L-1 | D. | $\frac{1000wd}{wM+1000}$ mol•L-1 |
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:選擇題
| A. | NaBiO3 | B. | Na4XeO6 | C. | K2S2O8 | D. | PbO2 |
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:填空題
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:解答題
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:解答題
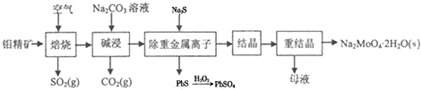
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:解答題
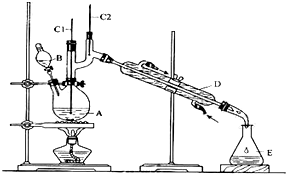
| 沸點/℃ | 密度/(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 11.72 | 0.8109 | 微溶 |
| 正丁醛 | 75.7 | 0.8017 | 微溶 |
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:解答題
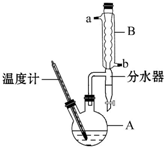 1-溴丙烷常用作有機反應(yīng)的溶劑.實驗室制備1-溴丙烷(CH3CH2CH2Br)的反應(yīng)和主要實驗裝置如圖:
1-溴丙烷常用作有機反應(yīng)的溶劑.實驗室制備1-溴丙烷(CH3CH2CH2Br)的反應(yīng)和主要實驗裝置如圖:| 相對分 子質(zhì)量 | 密度 /g•mL-1 | 沸點/℃ | 水中 溶解性 | |
| 正丙醇 | 60 | 0.896 | 97.1 | 溶 |
| 正丙醚 | 102 | 0.74 | 90 | 幾乎不溶 |
| 1-溴丙烷 | 123 | 1.36 | 71 | 不溶 |
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:實驗題
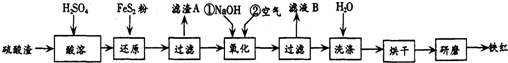
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 開始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com