
 Ⅰ.物質的量濃度相同的 ①氨水 ②氯化銨 ③碳酸氫銨 ④硫酸氫銨 ⑤硫酸銨 五種溶液中c(NH4+)大小的順序是(填序號)⑤>④>②>③>①
Ⅰ.物質的量濃度相同的 ①氨水 ②氯化銨 ③碳酸氫銨 ④硫酸氫銨 ⑤硫酸銨 五種溶液中c(NH4+)大小的順序是(填序號)⑤>④>②>③>①分析 Ⅰ.一水合氨是弱電解質,相同濃度的這幾種溶液中銨根離子濃度最小,碳酸氫根離子促進銨根離子水解、氫離子抑制銨根離子水解,根據離子水解程度結合化學式確定銨根離子濃度大小;
Ⅱ.(1)KMnO4具有強氧化性,會腐蝕橡膠管;
(2)可利用KMnO4溶液自身的顏色作為指示劑判斷滴定終點;
(3)由題給化學方程式及數據計算出1.260g純草酸晶體中含H2C2O4的物質的量,然后求出1.260g 純草酸晶體中含H2O的物質的量,根據H2O的物質的量和純草酸晶體的物質的量的關系求出x;若滴定終點時俯視滴定管讀數,則所得消耗酸性KMnO4溶液的體積偏小,由此所得n(H2C2O4)偏小,則n(H2O)偏大,若滴定時所用的酸性KMnO4溶液因久置而導致濃度變小,會導致濃度變小.
解答 解:I.一水合氨是弱電解質,在水溶液里部分電離,所以相同濃度的這幾種溶液中銨根離子濃度最小,硫酸銨中銨根離子個數是2,所以硫酸銨中銨根離子濃度最大,碳酸氫根離子促進銨根離子水解、氫離子抑制銨根離子水解,所以氯化銨、碳酸氫銨、硫酸氫銨中銨根離子濃度大小順序是④>②>③,則相同濃度的這幾種溶液中c(NH4+)的由大到小順序是⑤>④>②>③>①,
故答案為:⑤>④>②>③>①;
II. (1)因為KMnO4具有強氧化性,會腐蝕橡膠管,故應用酸式滴定管盛裝,故答案為:甲;
(2)可利用KMnO4溶液自身的顏色作為指示劑判斷滴定終點時,再滴加KMnO4溶液時,溶液將由無色變為紫色,
故答案為:當滴入最后一滴KMnO4溶液時,溶液由無色變為紫色,且半分鐘內不褪色,即達滴定終點;
(3)2MnO4-+5H2C2O4 +6H+═2Mn2++10CO2↑+8H2O
2 5
0.1000mol/L×0.01L 0.0025mol
25.00mL待測液中含有0.0025molH2C2O4,100.00mL待測液中含有0.01molH2C2O4,0.01molH2C2O4的質量為0.01mol
×90g/mol=0.9g,所以1.260g純草酸晶體中水的物質的量為1.260g-0.9g=0.36g,其物質的量為0.02mol,則x=2,
故答案為:2;
①若滴定終點時俯視滴定管讀數,則所得消耗酸性KMnO4溶液的體積偏小,由此所得n(H2C2O4)偏小,則n(H2O)偏大,x偏大,
故答案為:偏大;
②若酸性KMnO4溶液因久置而導致濃度變小,則消耗其體積偏大,所得x值偏小,
故答案為:偏小.
點評 本題考查中物質的含量的測定、鹽類水解,為高考常見題型,題目難度中等,明確弱電解質的電離及鹽類水解特點、中和滴定的操作方法為解答關鍵,注意掌中和滴定的誤差分析方法與技巧,試題培養了學生的分析能力及化學計算能力.


科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 ,其中-R為烴基.
,其中-R為烴基.
 ;C的結構簡式
;C的結構簡式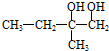 .
. .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | △H2>△H3>2△H1 | B. | △H1>△H2>△H3 | C. | △H2>△H1>△H3 | D. | △H3>△H2>2△Hl |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
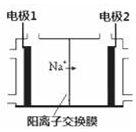 電解飽和食鹽水是重要的化工產業,它被稱為“氯堿工業”.在教材《化學1》、《化學2》、《化學反應原理》中均有提及,請寫出電解飽和食鹽水的化學反應方程式2NaCl+2H2O$\frac{\underline{\;通電\;}}{\;}$2NaOH+H2↑+Cl2↑.其中圖2是《化學反應原理》中電解飽和食鹽水工業中所采用的離子交換膜電解槽示意圖,部分圖標文字已被除去,請根據圖中殘留的信息,通電以后,Na+向右側移動,可判斷出電極2 是陰極,在該電極周圍的溶液中,NaOH濃度將會變大(填“變大”或“減小”或“不變”);電極1上的電極反應式為2Cl--2e-=Cl2↑.
電解飽和食鹽水是重要的化工產業,它被稱為“氯堿工業”.在教材《化學1》、《化學2》、《化學反應原理》中均有提及,請寫出電解飽和食鹽水的化學反應方程式2NaCl+2H2O$\frac{\underline{\;通電\;}}{\;}$2NaOH+H2↑+Cl2↑.其中圖2是《化學反應原理》中電解飽和食鹽水工業中所采用的離子交換膜電解槽示意圖,部分圖標文字已被除去,請根據圖中殘留的信息,通電以后,Na+向右側移動,可判斷出電極2 是陰極,在該電極周圍的溶液中,NaOH濃度將會變大(填“變大”或“減小”或“不變”);電極1上的電極反應式為2Cl--2e-=Cl2↑.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
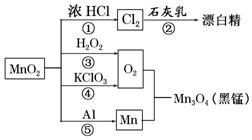
| A. | 只有反應①②④屬于氧化還原反應 | |
| B. | 反應⑤說明該條件下鋁可用于制熔點較高的金屬 | |
| C. | 相同條件下生成等量的O2,反應③和④轉移的電子數之比為1:1 | |
| D. | 反應①中氧化劑與還原劑的物質的量之比為1:4 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 如圖把氣體緩慢通過盛有足量試劑的試劑瓶A,在試管B中可以觀察到明顯現象的是( )
如圖把氣體緩慢通過盛有足量試劑的試劑瓶A,在試管B中可以觀察到明顯現象的是( )| 選項 | 氣體 | A中試劑 | B中試劑 |
| A | SO2、CO2 | 酸性KMnO4溶液 | 品紅溶液 |
| B | Cl2、HCl | 濃硫酸 | KI淀粉溶液 |
| C | NH3、CO2 | 濃硫酸 | 酚酞試液 |
| D | C2H4、CH4 | 酸性KMnO4溶液 | 溴的CCl4溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 壓強 溫度 | 1×105Pa | 5×105Pa | 10×105Pa | 50×105Pa | 100×105Pa |
| 450℃ | 97.5 | 98.9 | 99.2 | 99.6 | 99.7 |
| 500℃ | 85.6 | 92.9 | 94.9 | 97.7 | 98.3 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com