
 )與季戊四醇(
)與季戊四醇( )以物質的量之比2:1 反應
)以物質的量之比2:1 反應 .
. 分析 (1)根據蓋斯定律,由已知熱化學方乘以適當的系數進行加減構造目標熱化學方程式,反應熱也乘以相應的系數并進行相應的加減,據此計算;
(2)根據氧化劑CuSO4得到的電子等于還原劑白磷失去的電子來分析;
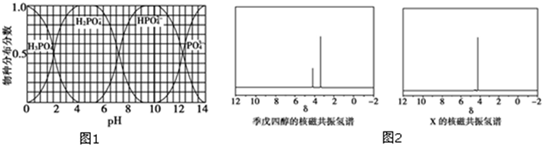
(3)①根據為獲得盡可能純的NaH2PO4,pH應控制從圖表中找出H2PO4-分布分數最大值所在區間;溶液中主要含磷物種濃度大小關系可由圖表得出;
②HPO42-離子既能發生電離又能發生水解,溶液呈堿性,說明水解程度大于電離程度,根據HPO42-離子和Ca2+離子反應生成沉淀使得水解程度小于電離程度;
(4)根據核磁共振氫譜可知:季戊四醇中有兩種氫原子,而新型阻燃劑中間體X中只有一種氫原子,說明三氯氧磷(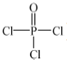 )與季戊四醇(
)與季戊四醇( )以物質的量之比2:1 反應時,季戊四醇中羥基氫全部消失,生成氯化氫酸性氣體.
)以物質的量之比2:1 反應時,季戊四醇中羥基氫全部消失,生成氯化氫酸性氣體.
解答 解:(1)①2Ca3(PO4)2(s)+10C(s)═6CaO(s)+P4(s)+10CO(g)△H1=+3359.26 kJ•mol-1
②CaO(s)+SiO2(s)═CaSiO3(s)△H2=-89.61kJ•mol-1
①+②×6得2Ca3(PO4)2(s)+6SiO2(s)+10C(s)═6CaSiO3(s)+P4(s)+10CO(g)△H3=△H1+△H2×6=+2821.6kJ•mol-1,
故答案為:+2821.6;
(2)CuSO4中銅的化合價由+2價變為+1價,1個CuSO4得到1個電子,60molCuSO4共得到電子60mol,白磷中磷的化合價由0價變為+5價,1個白磷得到20個電子,所以60molCuSO4能氧化白磷的物質的量為3mol,
故答案為:3mol;
(3)①為獲得盡可能純的NaH2PO4,pH應控制從圖表中找出H2PO4-分布分數最大值所在區間,即4~5.5(介于此區間內的任意值或區間均可),溶液中主要含磷物種濃:度大小關系可由圖表得出 c(HPO42-)>c(H2PO4-),
故答案為:4~5.5(介于此區間內的任意值或區間均可);c(HPO42-)>c(H2PO4-);
②HPO42-離子既能發生電離又能發生水解,電離反應式為HPO42-?PO43-+H+,水解反應式為HPO42-+H2O?H2PO4-+OH-,溶液呈堿性,說明水解程度大于電離程度;
由于HPO42-離子和Ca2+離子反應生成沉淀:3Ca2++2HPO42-═Ca3(PO4)2↓+2H+,使得水解程度小于電離程度,溶液則顯酸性,
故答案為:3Ca2++2HPO42-═Ca3(PO4)2↓+2H+;
(4)核磁共振氫譜可知:季戊四醇中有兩種氫原子,而新型阻燃劑中間體X中只有一種氫原子,說明三氯氧磷( )與季戊四醇(
)與季戊四醇( )以物質的量之比2:1 反應時,季戊四醇中羥基氫全部消失,生成氯化氫酸性氣體,X的結構簡式為:
)以物質的量之比2:1 反應時,季戊四醇中羥基氫全部消失,生成氯化氫酸性氣體,X的結構簡式為: ;
;
故答案為:①HCl; ② .
.
點評 本題圍繞磷及其化合物展開,涉及元素化合物性質、熱化學方程式、氧化還原反應判斷、離子反應方程式的書寫、讀圖讀表、pH控制、核磁共振氫譜等知識,難度中等以上.


科目:高中化學 來源: 題型:選擇題
| A. | 同溫同壓同體積的氣體單質所含原子個數相等 | |
| B. | 常溫常壓下,11.2LO2所含的氧原子數為NA | |
| C. | 摩爾是溝通宏觀和微觀的橋梁 | |
| D. | 大規模海水淡化采用蒸餾法 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 在25℃,101KPa的條件下,將共8L的CO和O2的混合氣體通入一個帶可自由移動活塞容積可變但壓強不變的密閉容器中(如圖所示),用電火花點燃充分反應后恢復至原來的條件,測得氣體的密度變為原來的$\frac{4}{3}$,求
在25℃,101KPa的條件下,將共8L的CO和O2的混合氣體通入一個帶可自由移動活塞容積可變但壓強不變的密閉容器中(如圖所示),用電火花點燃充分反應后恢復至原來的條件,測得氣體的密度變為原來的$\frac{4}{3}$,求查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在蒸發皿中放入NaCl溶液,加熱、蒸發所有水分得到NaCl晶體 | |
| B. | 用10 mL的量筒量取5.2 mL的鹽酸 | |
| C. | 用托盤天平稱取25.20 g NaCl | |
| D. | 用1 000 mL容量瓶配制450 mL 0.1 mol•L-1的鹽酸 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 該分散系能發生丁達爾現象 | B. | 分散質顆粒能透過濾紙 | ||
| C. | 該分散質顆粒大小在1~100 nm之間 | D. | 該分散系很不穩定 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com