
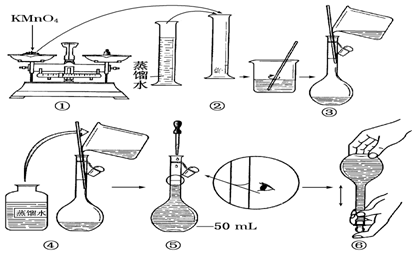
分析 (1)根據配制一定物質的量濃度的溶液的正確操作結合圖示分析解答;
(2)容量瓶是確定溶液體積的儀器;
(3)依據仰視刻度線,會使溶液體積偏大判斷,結合C=$\frac{n}{V}$分析;
(4)草酸跟酸性KMnO4溶液反應生成二氧化碳、二價錳離子等,結合氧化還原反應得失電子守恒和根據電荷守恒進行分析寫出化學方程式得到x;
(5)滴定時,用高錳酸鉀滴定草酸,反應達到終點時,滴入的高錳酸鉀溶液不褪色,據此判斷;
(6)根據滴定數據及鈣離子與高錳酸鉀的關系式計算出血液樣品中Ca2+的濃度.
解答 解:(1)由圖示可知②⑤操作不正確,②不能在量筒中溶解固體,⑤定容時應平視刻度線,至溶液凹液面與刻度線相切,故答案為:②⑤;
(2)應該用容量瓶準確確定50mL溶液的體積,故答案為:容量瓶;
(3)如果用圖示的操作配制溶液,由于仰視刻度線,會使溶液體積偏大,所配制的溶液濃度將偏小,故答案為:偏小;
(4)根據電荷守恒,(-1×2)+(+1×6)=+x×2,解得,x=2,草酸跟KMnO4反應的離子方程式為:2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O,
故答案為:2;
(5)滴定時,用高錳酸鉀滴定草酸,反應達到終點時的現象為溶液由無色變為紫紅色,且半分鐘內不褪色,
故答案為:溶液由無色變為紫紅色,且半分鐘內不褪色;
(6)血樣20.00mL經過上述處理后得到草酸,草酸消耗的消耗的高錳酸鉀的物質的量為:0.020mol/L×0.012L=2.4×10-4mol,
根據反應方程式2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O,及草酸鈣的化學式CaC2O4,可知:n(Ca2+)=n(H2C2O4)=$\frac{5}{2}$n(MnO4-)=2.5×2.4×10-4mol=6
10-4mol,Ca2+的質量為:40g/mol×6×10-4mol=0.024g,鈣離子的濃度為:$\frac{0.024g}{20cm{\;}^{3}}$=1.2 mg/cm3,
故答案為:1.2.
點評 本題考查了配制一定物質的量濃度的方法及誤差分析,題目難度不大,注意掌握配制一定濃度的溶液的方法及誤差分析方法及技巧


科目:高中化學 來源: 題型:選擇題
| 序號 | 物質 | 試劑 | 分離方法 |
| ① | 硝酸鉀(氯化鈉) | 蒸餾水 | 重結晶 |
| ② | 二氧化碳(氯化氫) | 飽和碳酸鈉溶液 | 洗氣 |
| ③ | 乙醇(水) | 金屬鈉 | 蒸餾 |
| ④ | NaCl溶液(Na2S) | AgCl | 過濾 |
| A. | ①③ | B. | ①④ | C. | ② | D. | ③④ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 分子中3個碳原子在同一直線 | B. | 分子中所有原子在同一平面上 | ||
| C. | 與氯化氫加成只生成一種產物 | D. | 能發生加聚反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:計算題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 溶 液 | 加入的物質 | 答案序號 |
| (1)飽和石灰水 | CO2 | |
| (2)AlCl3溶液 | 過量NH3 | |
| (3)含少量NaOH的NaAlO2 | 過量CO2 | |
| (4)含少量NaOH的NaAlO2 | 逐滴加稀鹽酸 | |
| (5)MgCl2、AlCl3混合液 | 逐滴加NaOH至過量 | |
| (6)NaOH溶液 | 逐滴加AlCl3至過量 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NH3、CH4的分子數之比為1:1 | B. | NH3、CH4兩種氣體的密度之比為a:b | ||
| C. | NH3、CH4的摩爾質量之比為17:16 | D. | NH3、CH4的物質的量之比為a:b |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
 某實驗小組用如圖裝置制備家用消毒液,并探究其性質.反應停止后,取洗氣瓶中無色溶液5mL,分別進行了如下實驗:
某實驗小組用如圖裝置制備家用消毒液,并探究其性質.反應停止后,取洗氣瓶中無色溶液5mL,分別進行了如下實驗:| 操作 | 現象 |
| a.測溶液pH,并向其中滴加2滴酚酞 | pH=3,溶液變紅,5min后褪色 |
| b.向其中逐滴加入鹽酸 | 溶液逐漸變成黃綠色 |
| 操作 | 現象 |
| 取5mLpH=13NaOH溶液,向其中滴加2滴酚酞 | 溶液變紅,30min后褪色 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com