
【題目】在一定溫度下的恒容密閉容器中,當下列哪些物理量不再發生變化時,表明下述反應: A(g)+2B(g)![]() C(g)+D(g)已達到平衡狀態( )
C(g)+D(g)已達到平衡狀態( )
①混合氣體的壓強 ②混合氣體的密度 ③B的物質的量濃度 ④混合氣體的總物質的量
⑤混合氣體的平均相對分子質量 ⑥混合氣體的總質量 ⑦C、D的濃度之比等于化學計量數之比
A.全部B.①③④⑤C.②③④⑤D.①②③④⑤⑦
【答案】B
【解析】
①因為A(g)+2B(g)![]() C(g)+D(g)兩邊計量數不等,所以混合氣體的壓強不變,可以判斷反應達到平衡狀態,故①符合題意;
C(g)+D(g)兩邊計量數不等,所以混合氣體的壓強不變,可以判斷反應達到平衡狀態,故①符合題意;
②因為是恒容密閉容器中進行的反應,且反應物和生成物都是氣體,所以混合氣體的密度不變,不能判斷已達到平衡狀態,故②不符合題意;
③當B的物質的量濃度不變時,說明反應達到化學平衡狀態了,故③符合題意;
④因為A(g)+2B(g)![]() C(g)+D(g)兩邊計量數不等,當混合氣體的總物質的量不變時,說明反應達到平衡狀態了,故④符合題意;
C(g)+D(g)兩邊計量數不等,當混合氣體的總物質的量不變時,說明反應達到平衡狀態了,故④符合題意;
⑤因為平均相對分子質量M=![]() ,所以當混合氣體的平均相對分子質量不變時,說明反應達到平衡狀態了,故⑤符合題意;
,所以當混合氣體的平均相對分子質量不變時,說明反應達到平衡狀態了,故⑤符合題意;
⑥根據質量守恒定律,當混合氣體的總質量不變時,不能說明反應達到平衡狀態了,故⑥不符合題意;
⑦C、D為生成物,所以濃度之比等于化學計量數之比,因此不能作為判斷平衡的依據,故⑦不符合題意;
故①③④⑤符合題意,故B正確;
答案:B。


科目:高中化學 來源: 題型:
【題目】25℃時,部分含鐵元素的微粒在溶液中的物質的量分數與溶液pH的關系如圖所示。下列說法錯誤的是( )

A.pH=4時,溶液中存在下列關系c(HFeO4-)>c(H2FeO4)>c(FeO42-)
B.H2FeO4的第一步電離平衡常數Ka1=4.15×10-4
C.B點溶液加NaOH溶液到pH為4的過程中,![]() 減小
減小
D.B、C兩點對應溶液中水的電離程度:B<C
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氫疊氮酸(HN3)和莫爾鹽[(NH4)2SO4·FeSO4·6H2O]是兩種常用原料。
(1)氫疊氮酸易溶于水,25℃時,該酸的電離常數為Ka=10×10-5。
①氫疊氮酸在水溶液中的電離方程式為_______
②0.2mol/L的HN3溶液與0.1mol/L的NaOH溶液等體積混合后,恢復到25℃,此時,溶液呈酸性,則混合溶液中各離子和HN3分子濃度由大到小的順序為_______。
(2)在FeSO4溶液中,加入(NH4)2SO4固體可制備莫爾鹽晶體[(NH4)2Fe(SO4)2·6H2O],為了測定產品純度,稱取ag產品溶于水,配制成500mL溶液,用濃度為cmol/L的酸性高錳酸鉀溶液滴定,每次所取待測液體積均為25.00mL,實驗結果記錄如下:(已知莫爾鹽的分子量為392)
實驗次數 | 第一次 | 第二次 | 第三次 |
消耗KMnO4溶液體積/mL | 25.52 | 25.02 | 24.98 |
①配制莫爾鹽溶液,所使用的玻璃儀器除了燒杯和玻璃棒外還有_______
②滴定終點的現象是_______,通過實驗數據,計算該產品的純度為_______(用含字母a、c的式子表示)。
③上表第一次實驗中記錄數據明顯大于后兩次,其原因可能是_______。
A 第一次滴定時,錐形瓶用待裝液潤洗
B 該酸性高錳酸鉀標準液保存時間過長,部分變質
C 滴定前酸式滴定管中尖嘴處有氣泡,滴定結束后氣泡消失
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】環戊二烯(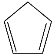 )是重要的有機化工原料,廣泛用于農藥、橡膠、塑料等生產。回答下列問題:
)是重要的有機化工原料,廣泛用于農藥、橡膠、塑料等生產。回答下列問題:
(1)已知:![]() (g)
(g) ![]()
![]() (g)+H2(g) ΔH1=100.3 kJ·mol 1①H2(g)+ I2(g)
(g)+H2(g) ΔH1=100.3 kJ·mol 1①H2(g)+ I2(g) ![]() 2HI(g) ΔH2=11.0 kJ·mol 1②,對于反應:
2HI(g) ΔH2=11.0 kJ·mol 1②,對于反應:![]() (g)+ I2(g)
(g)+ I2(g) ![]()
![]() (g)+2HI(g) ③ ΔH3=___________kJ·mol 1。
(g)+2HI(g) ③ ΔH3=___________kJ·mol 1。
(2)某溫度下,等物質的量的碘和環戊烯(![]() )在剛性容器內發生反應③,起始總壓為105Pa,平衡時總壓增加了20%,環戊烯的轉化率為_________,該反應的平衡常數Kp=_________Pa。達到平衡后,欲增加環戊烯的平衡轉化率,可采取的措施有__________(填標號)。
)在剛性容器內發生反應③,起始總壓為105Pa,平衡時總壓增加了20%,環戊烯的轉化率為_________,該反應的平衡常數Kp=_________Pa。達到平衡后,欲增加環戊烯的平衡轉化率,可采取的措施有__________(填標號)。
A.通入惰性氣體 B.提高溫度 C.增加環戊烯濃度 D.增加碘濃度
(3)環戊二烯容易發生聚合生成二聚體,該反應為可逆反應。不同溫度下,溶液中環戊二烯濃度與反應時間的關系如圖所示,下列說法正確的是__________(填標號)。

A.T1>T2
B.a點的反應速率小于c點的反應速率
C.a點的正反應速率大于b點的逆反應速率
D.b點時二聚體的濃度為0.45 mol·L1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鉛及其化合物用廣泛,請回答下列相關問題:
(1)鉛是碳的同族元素,比碳多4個電子層。鉛元素的原子結構示意圖為____________;相同溫度下,同濃度的![]() 溶液和
溶液和![]() 溶液中水的電離程度___________(填“前者大”“后者大”或“一樣大”)。
溶液中水的電離程度___________(填“前者大”“后者大”或“一樣大”)。
(2)工業上利用鋅冶煉過程中的鉛浮渣(主要成分是![]() 、
、![]() ,含有少量
,含有少量![]() 、
、![]() 和其他不溶于硝酸的雜質)生產硫酸鉛和硫化鉛納米粒子,流程如圖所示:
和其他不溶于硝酸的雜質)生產硫酸鉛和硫化鉛納米粒子,流程如圖所示:
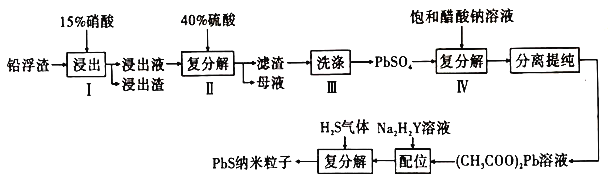
已知:a.25℃時,![]() ,
,![]() ,
,![]() 。
。
b.![]() 二鈉簡寫成
二鈉簡寫成![]() ,可以與
,可以與![]() 及其他許多金屬離子形成穩定的配離子。
及其他許多金屬離子形成穩定的配離子。
①已知步驟Ⅰ有![]() 產生,
產生,![]() 被足量稀硝酸氧化成
被足量稀硝酸氧化成![]() 。寫出
。寫出![]() 參加反應的離子方程式:________。
參加反應的離子方程式:________。
②步驟Ⅰ需控制硝酸的用量并使![]() 稍有剩余,原因是_________________________。
稍有剩余,原因是_________________________。
③硫酸鉛微溶于水,醋酸鉛易溶于水,步驟Ⅳ能發生反應的原因是____________________。
④不用硫化氫氣體直接通入![]() 溶液來制備
溶液來制備![]() 納米粒子的原因是__________________。
納米粒子的原因是__________________。
⑤已知鉛蓄電池工作時會產生![]() ,則鉛蓄電池
,則鉛蓄電池![]() 充電時的陽極反應式為________________________________。
充電時的陽極反應式為________________________________。
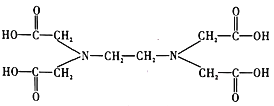
⑥![]() 又名乙二氨四乙酸,是一種弱酸(結構如圖),在水溶液中可形成內鹽(總電荷為0,電中性的化合物,但是帶正電和負電的原子不同)。據此寫出
又名乙二氨四乙酸,是一種弱酸(結構如圖),在水溶液中可形成內鹽(總電荷為0,電中性的化合物,但是帶正電和負電的原子不同)。據此寫出![]() 的結構:_________________。
的結構:_________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】三氯化磷![]() 和三氯氧磷
和三氯氧磷![]() ,是兩種重要的化工原料。
,是兩種重要的化工原料。
(1)實驗室制備![]() 的裝置圖(如圖)和有關信息如下:
的裝置圖(如圖)和有關信息如下:

物質 | 熔點/℃ | 沸點/℃ | 密度 | 性質 |
白磷 | 44.1 | 280.5 | 1.82 | 濕空氣中約40℃著火 |
|
| 74.2 | 1.574 | 無色液體,遇水均劇烈水解,互溶 |
| 2.0 | 105.3 | 1.675 |
①實驗開始先打開![]() 通入
通入![]() 排除裝置內空氣的目的是______________________。
排除裝置內空氣的目的是______________________。
②實驗制得的粗產品中含有![]() ,可用_______方法提純。
,可用_______方法提純。
③![]()
![]() 和
和![]() ,水解后的溶液中除
,水解后的溶液中除![]() 之外其他離子的濃度由大到小的順序是___________________________________(已知
之外其他離子的濃度由大到小的順序是___________________________________(已知![]() 是二元弱酸)。
是二元弱酸)。
(2)實驗室通常用![]() 直接氧化
直接氧化![]() 制備
制備![]() ,工業上通常采用潮濕的
,工業上通常采用潮濕的![]() 氧化
氧化![]() 制備
制備![]() ,請寫出工業制備的反應方程式:______________________________________。從原理上分析,實驗室制備方法的優點是_________________________________________________(寫出兩點)。
,請寫出工業制備的反應方程式:______________________________________。從原理上分析,實驗室制備方法的優點是_________________________________________________(寫出兩點)。
(3)用![]() 標準溶液定量測定實驗室制備的
標準溶液定量測定實驗室制備的![]() 粗產品的純度,實驗步驟如下:
粗產品的純度,實驗步驟如下:
①取![]() 粗產品溶于水至完全水解,預處理排除磷酸根離子的影響,加入
粗產品溶于水至完全水解,預處理排除磷酸根離子的影響,加入![]() 溶液,完全反應后加少量硝基苯,用力搖動,靜置,使沉淀表面被有機物覆蓋,防止實驗測得的
溶液,完全反應后加少量硝基苯,用力搖動,靜置,使沉淀表面被有機物覆蓋,防止實驗測得的![]() 純度___________(填“偏大”“偏小”或“不變”)。[已知:
純度___________(填“偏大”“偏小”或“不變”)。[已知:![]() ]
]
②滴加![]() 作指示劑,用
作指示劑,用![]() 溶液滴定過量的
溶液滴定過量的![]() 溶液,當溶液__________________________,即為終點。共用去
溶液,當溶液__________________________,即為終點。共用去![]() 溶液,則粗產品中
溶液,則粗產品中![]() 的純度為_________%(保留小數點后1位)。
的純度為_________%(保留小數點后1位)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】明代宋應星所著的《天工開物》中,有關于火法煉鋅的工藝記載:“每爐甘石十斤,裝載入一泥罐內,……然后逐層用煤炭餅墊盛,其底鋪薪,發火煅紅,罐中爐甘石熔化成團,冷定毀罐取出。……即倭鉛也。……以其似鉛而性猛,故名之曰‘倭’云。”(注:爐甘石的主要成分為碳酸鋅。)下列說法正確的是( )
A.該冶煉金屬的方法屬于熱分解法
B.該反應中還原劑是C,還原產物是鉛
C.冶煉鋅的過程中發生ZnCO3+2C![]() Zn+3CO↑
Zn+3CO↑
D.倭鉛是指金屬鋅和鉛的混合物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】非線性光學晶體在信息、激光技術、醫療、國防等領域具有重要應用價值。我國科學家利用Cs2CO3、XO2(X=Si、Ge)和H3BO3首次合成了組成為CsXB3O7的非線性光學晶體。回答下列問題:
(1)C、O、Si三種元素電負性由大到小的順序為__;第一電離能I1(Si)__I1(Ge)(填>或<)。
(2)基態Ge原子核外電子排布式為__;SiO2、GeO2具有類似的晶體結構,其中熔點較高的是__。
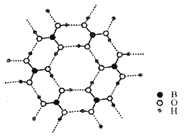
(3)如圖為H3BO3晶體的片層結構,其中B的雜化方式為__;硼酸在熱水中比在冷水中溶解度顯著增大的主要原因是__。
(4)以晶胞參數為單位長度建立的坐標系可以表示晶胞中各原子的位置,稱作原子分數坐標。CsSiB3O7屬正交晶系(長方體形),晶胞參數為apm、bpm和和cpm。如圖為沿y軸投影的晶胞中所有Cs原子的分布圖和原子分數坐標。據此推斷該晶胞中Cs原子的數目為__;CsSiB3O7的摩爾質量為Mg.mol-1,設NA為阿伏加德羅常數的值,則CsSiB3O7晶體的密度為__g·cm-3(用代數式表示)。
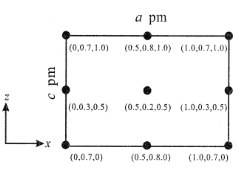
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】丁苯橡膠的結構簡式為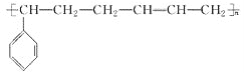 ,對丁苯橡膠廢舊物(以純凈物計)進行催化分解可得到乙烯、乙炔(HC≡CH)。下列說法正確的是( )
,對丁苯橡膠廢舊物(以純凈物計)進行催化分解可得到乙烯、乙炔(HC≡CH)。下列說法正確的是( )
A.丁苯橡膠薄膜可用于食品包裝
B.丁苯橡膠粉末加入到溴水中不會產生褪色現象
C.合成丁苯橡膠的單體只有1種
D.若回收1.58t丁苯橡膠廢舊物(假設原子利用率為100%),則得到0.28t乙烯
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com