
分析 發生3Cu+8HNO3 =3Cu(NO3)2+4H2O+2NO↑,
(1)根據方程式計算生成一氧化氮物質的量根據V=n×Vm計算;
(2)根據方程式計算消耗的硝酸,用原由硝酸減去消耗的即為剩余的硝酸;
(3)根據消耗的硝酸根轉變為一氧化氮氣體解答;
(4)根據氫離子和Cu2+都消耗氫氧根離子,求出氫氧化鈉溶液的體積.
解答 解:(1)n(Cu)=$\frac{1.92g}{64g/mol}$=0.03mol,n(HNO3)=V•c=0.5L×0.2 mol•L-1=0.1 mol,
由3Cu+8HNO3 =3Cu(NO3)2+4H2O+2NO↑可知,稀硝酸過量,
設生成的一氧化氮物質的量為x,則
3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
3 2
0.03mol x
生成NO的物質的量x=$\frac{2×0.03mol}{3}$=0.02mol,標準狀況下所占的體積為V=n×Vm=0.02mol×22.4L/mol=0.448L,
故答案為:0.448L;
(2)設消耗硝酸的物質的量y
3Cu+8HNO3 =3Cu(NO3)2 +2NO↑+4H2O
3 8
0.03mol y
消耗硝酸的物質的量y=$\frac{0003mol×8}{3}$=0.08mol,則反應后溶液中H+的物質的量濃度是C=$\frac{n}{V}$=$\frac{0.1mol-0.08mol}{0.5L}$=0.04mol/L,
故答案為:0.04mol/L;
(3)500mL0.2mol•L-1的稀硝酸中n(NO3-)=0.1mol,由3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O可知,生成0.02molNO時消耗0.02mol硝酸根離子,反應后溶液中NO3-的物質的量為0.1mol-0.02mol=0.08mol,反應后溶液中NO3-的物質的量濃度是c=$\frac{n}{V}$=$\frac{0.08mol}{0.5L}$=0.16mol/L,
故答案為:0.16mol/L;
(4)因剩余的氫離子需要0.02mol氫氧根離子中和,每1mol銅離子需要2mol氫氧根離子轉化成氫氧化銅沉淀,這需要0.06mol氫氧根,所以一共需要的氫氧根離子0.02+0.06=0.08mol,也就是0.08mol氫氧化鈉氫氧化鈉體積為V=$\frac{n}{c}$=$\frac{0.02mol}{0.2mol/L}$=0.4L=400mL,
故答案為:400.
點評 本題考查化學反應方程式的計算,為高頻考點,把握發生的反應及物質的量的關系為解答的關鍵,側重分析與計算能力的考查,注意硝酸的性質、化學計算中的過量判斷以及守恒法的運用,題目難度中等.


 芝麻開花課程新體驗系列答案
芝麻開花課程新體驗系列答案 怎樣學好牛津英語系列答案
怎樣學好牛津英語系列答案科目:高中化學 來源: 題型:選擇題
| A. | 0.01% | B. | 0.1% | C. | 0.2% | D. | 1% |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 .
. .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
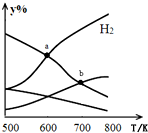 以二氧化碳和氫氣為原料制取乙醇的反應為:2CO2(g)+6H2(g)$\stackrel{催化劑}{?}$CH3CH2OH(g)+3H2O(g)△H<0某壓強下的密閉容器中,按CO2和H2的物質的量比為1:3投料,不同溫度下平衡體系中各物質的物質的量百分數(y%)隨溫度變化如圖所示.下列說法正確的是( )
以二氧化碳和氫氣為原料制取乙醇的反應為:2CO2(g)+6H2(g)$\stackrel{催化劑}{?}$CH3CH2OH(g)+3H2O(g)△H<0某壓強下的密閉容器中,按CO2和H2的物質的量比為1:3投料,不同溫度下平衡體系中各物質的物質的量百分數(y%)隨溫度變化如圖所示.下列說法正確的是( )| A. | a點的平衡常數小于b點 | |
| B. | b點,v正(CO2)=v逆(H2O) | |
| C. | a點,H2和H2O物質的量相等 | |
| D. | 其他條件恒定,充入更多H2,v(CO2)不變 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 還原性:HI>HBr>HCl>HF | |
| B. | 晶體熔點:金剛石>SiC>NaCl>Na>Mg>Al | |
| C. | 酸性:HClO4>H2SO4>H2SO3>HClO | |
| D. | 晶格能:MgF2>NaCl>NaBr |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 編號 | ① | ② | ③ | ④ |
| 裝置 |  |  |  |  |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 金屬A在常溫下能與濃硝酸反應,而B不能 | |
| B. | 金屬A的陽離子的氧化性比金屬B的陽離子的氧化性弱 | |
| C. | 工業上制取金屬A只能用電解的方法,而金屬B一般都用還原劑將其還原 | |
| D. | 將金屬A和金屬B用導線相連后插入某電解質溶液中構成原電池,金屬A作負極 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 碳氫原子個數比為1:3的烴有兩種 | |
| B. | 碳碳間以單鍵結合,碳原子剩余價鍵全部與氫原子結合的烴一定是飽和鏈烴 | |
| C. | 丙烷分子中的3個碳原子一定在同一平面上,丁烷分子中的4個碳原子不一定 | |
| D. | 常溫下,液態烷中僅有一種一氯代物的只有新戊烷 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com