
| 溫度 | 平衡濃度/(mol•L-1) | |
| c(NH3) | c(CO2) | |
| T1 | 0.1 | |
| T2 | 0.1 | |

分析 (1)根據能量圖可以分析,2NH3(g)+CO2(g)?CO(NH2)2(I)+H2O(I)為放熱反應,所以△H<0,2NH3(g)+CO2(g)?NH2COONH4(s)為放熱反應,所以△H1
<0,并且△H1<△H<0,NH2COONH4(s)?CO(NH2)2(I)+H2O(I)為吸熱反應,所以△H2>0,據此分析;
(2)圖象分析氨氣的體積分數從50%變化為20%后體積分數保持不變,說明B點反應達到平衡狀態,A點氨氣體積百分含量大于B的氨氣體積百分含量,說明反應正向進行達到平衡狀態,A點的正反應速率大于B點的正反應速率;依據氨氣的體積分數結合平衡三段式列式計算平衡轉化率;
(3)①根據(1)的分析,2NH3(g)+CO2(g)?NH2COONH4(s)為放熱反應,所以,△H1<0,所以H2NCOONH4(s)?2NH3(g)+CO2(g)為吸熱反應,溫度越高平衡產物越多,據此分析;
②當反應達到平衡狀態時,正逆反應速率相等,各物質的濃度不再改變,由此衍生的一些物理量也不變,以此進行判斷;
(4)根據氨基甲酸銨極易水解成碳酸銨,即反應式為NH2COONH4(s)+H2O?(NH4)2CO3,將氨基甲酸銨粉末逐漸加入1L0.1mol/L的鹽酸溶液中直到pH=7并且溶液中幾乎不含碳元素,所以溶液中只有H+、NH4+、OH-、Cl-,根據電荷守恒計算c(NH4+),根據NH4++H2O?NH3•H2O+OH-結合K=$\frac{c(NH{\;}_{3}•H{\;}_{2}O)c(H{\;}^{+})}{c(NH{\;}_{4}{\;}^{+})}$進行計算.
解答 解:(1)根據能量圖可以分析,2NH3(g)+CO2(g)?CO(NH2)2(I)+H2O(I)為放熱反應,所以△H<0,2NH3(g)+CO2(g)?NH2COONH4(s)為放熱反應,所以△H1<0,并且△H1<△H<0,NH2COONH4(s)?CO(NH2)2(I)+H2O(I)為吸熱反應,所以△H2>0,所以△H2>△H>△H1;故答案為:△H2>△H>△H1;
(2)氨氣的體積分數從50%變化為20%后體積分數保持不變,說明B點反應達到平衡狀態,A點氨氣體積百分含量大于B的氨氣體積百分含量,說明反應正向進行達到平衡狀態,A點的正反應速率大于B點的正反應速率,故v正(CO2)>v逆(CO2);
設氨氣消耗物質的量x,開始氨氣體積分數為50%,假設氨氣為50mol,二氧化碳為50mol,
CO2+2NH3?(NH2)2CO+H2O
起始量(mol) 50 50 0 0
變化量(mol) 0.5x x 0.5x 0.5x
平衡量(mol) 50-0.5x 50-x 0.5x 0.5x
氨氣的體積分數=$\frac{50-x}{50-0.5x+50-x+0.5x}$=20%;解得x=37.5mol,
氨氣的平衡轉化率=$\frac{37.5mol}{50mol}$×100%=75%,
故答案為:>;75%;
(2)①根據(1)的分析,2NH3(g)+CO2(g)?NH2COONH4(s)為放熱反應,所以,△H1<0,所以H2NCOONH4(s)?2NH3(g)+CO2(g)為吸熱反應,溫度越高平衡產物越多,又T1平衡時c(NH3)為0.1mol/L,則二氧化碳濃度為0.05mol/L,又T2平衡時二氧化碳濃度為0.1mol/L,所以T1<T2;故答案為:<;
②a.根據反應速率之比等于系數之比,則v生成(NH3)=2v生成(CO2)=2v消耗(CO2),所以正逆反應速率相等,能判斷平衡,故a正確;
b.根據質量守恒,密閉容器內物質的總質量一直不變,所以不能判斷平衡,故b錯誤;
c.因為該反應正反應為氣體質量增加的反應,又體積不變,所以密閉容器中混合氣體的密度一直在變,則當密度不變時,能判斷平衡,故c正確;
d.因為反應物為固體,所以生成物氨氣和二氧化碳一直為2:1,則密閉容器中氨氣的體積分數一直不變,所以不能判斷平衡,故d錯誤;
故選:ac;
(4)因為氨基甲酸銨極易水解成碳酸銨,即反應式為NH2COONH4(s)+H2O?(NH4)2CO3,加入1L0.1mol/L的鹽酸溶液中直到溶液pH=7并且溶液中幾乎不含碳元素,所以溶液中只有H+、NH4+、OH-、Cl-,根據電荷守恒c(NH4+)=c(Cl-)=0.1mol/L,又用去0.052mol氨基甲酸銨,所以開始溶液中的銨根離子濃度為0.052mol/L×2=0.104mol/L,
NH4++H2O?NH3•H2O+H+;
開始 0.104mol/L 0
轉化 0.004mol/L 0.004mol/L
平衡 0.1mol/L 0.004mol/L
又溶液為pH=7,所以氫離子濃度為10-7mol/L,則NH4+水解平衡常數K=$\frac{c(NH{\;}_{3}•H{\;}_{2}O)c(H{\;}^{+})}{c(NH{\;}_{4}{\;}^{+})}$=$\frac{0.004×10{\;}^{-7}}{0.1}$=4×10-9,故答案為:0.1mol/L;4×10-9.
點評 本題考查化學反應速率、化學平衡的移動原理、弱堿根離子在溶液中的水解平衡的計算應用等知識,綜合性較大,難度中等.


 新課標階梯閱讀訓練系列答案
新課標階梯閱讀訓練系列答案科目:高中化學 來源: 題型:解答題
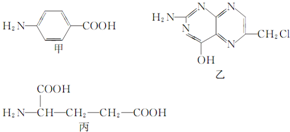 葉酸是維生素B族之一,可以由下列甲、乙、丙三種物質合成.
葉酸是維生素B族之一,可以由下列甲、乙、丙三種物質合成.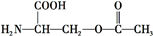 .
.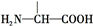
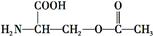 +2NaOH→HOCH2CH(NH2)COONa+H2O+CH3COONa.
+2NaOH→HOCH2CH(NH2)COONa+H2O+CH3COONa.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 方案Ⅱ比方案Ⅰ操作簡便 | |
| B. | 等質量的鋅,相同條件下方案Ⅰ和方案Ⅱ中制得的銅的質量相同 | |
| C. | 等質量的H2SO4參加反應,方案Ⅰ制取銅的質量比方案Ⅱ的少 | |
| D. | 為了加快鋅與稀硫酸反應,可以在溶液中加入少量氧化銅 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
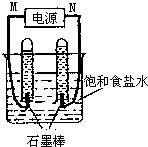 利用反應CO(g)+H2(g)+O2(g)?H2O(g)+CO2(g)設計而成的MCFS燃料電池是一種新型電池.現以該燃料電池為電源,以石墨作電極電解飽和NaCl溶液,反應裝置及現象如圖所示.則①M應是電源的負極(填“正”或“負”);②該電解反應的化學方程式是2NaCl+2H2O$\frac{\underline{\;電解\;}}{\;}$2NaOH+H2↑+Cl2↑;③已知飽和食鹽水的體積為1L,一段時間后,測得左側試管中氣體體積為11.2mL(標準狀況),若電解前后溶液的體積變化忽略不計,電解后將溶液混合均勻,此時溶液的pH為11.
利用反應CO(g)+H2(g)+O2(g)?H2O(g)+CO2(g)設計而成的MCFS燃料電池是一種新型電池.現以該燃料電池為電源,以石墨作電極電解飽和NaCl溶液,反應裝置及現象如圖所示.則①M應是電源的負極(填“正”或“負”);②該電解反應的化學方程式是2NaCl+2H2O$\frac{\underline{\;電解\;}}{\;}$2NaOH+H2↑+Cl2↑;③已知飽和食鹽水的體積為1L,一段時間后,測得左側試管中氣體體積為11.2mL(標準狀況),若電解前后溶液的體積變化忽略不計,電解后將溶液混合均勻,此時溶液的pH為11.查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 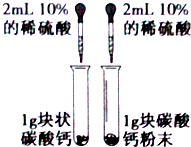 用圖裝置探究反應物接觸面積對反應速率影響 | |
| B. | 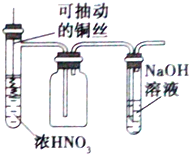 用圖裝置制取并收集少量的NO2氣體(不考慮倒吸) | |
| C. |  用圖裝置制取并收集少量的氯氣 | |
| D. |  用圖裝置制取少量乙酸乙酯 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | C$\stackrel{在空氣中點燃}{→}$CO$\stackrel{CuO,△}{→}$CO2$\stackrel{NaOH溶液}{→}$Na2CO3 | |
| B. | Cu$\stackrel{AgNO_{3}溶液}{→}$Cu(NO3)2溶液$\stackrel{NaOH溶液}{→}$Cu(OH)2 | |
| C. | Fe$\stackrel{點燃}{→}$Fe2O3$\stackrel{H_{2}SO_{4}溶液}{→}$Fe2(SO4)3溶液 | |
| D. | CaO$\stackrel{H_{2}O}{→}$Ca(OH)2溶液$\stackrel{Na_{2}CO_{3}}{→}$NaOH溶液 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com