
分析 (1)當反應達到平衡時共放出熱量196kJ,可知參加反應的SO2為$\frac{196kJ}{98kJ/mol}$=2mol,則
SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)
開始 4 10 0
轉化 2 1 2
平衡 2 9 2
結合平衡濃度計算K;
(2)該反應為放熱反應,升高溫度,平衡逆向移動,K減小;
(3)A.保持容器的體積不變,當混合氣體的密度始終不變;
B.由質量守恒定律可知,混合氣體中硫元素的質量分數不變;
C.達到平衡時若減小容器的體積,壓強增大,平衡正向移動;
D.起始量之比不等于化學計量數之比.
解答 解:(1)當反應達到平衡時共放出熱量196kJ,可知參加反應的SO2為$\frac{196kJ}{98kJ/mol}$=2mol,則
SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)
開始 4 10 0
轉化 2 1 2
平衡 2 9 2
平衡濃度分別為0.02mol/L、0.09mol/L、0.02mol/L,
K=$\frac{0.02}{0.02×\sqrt{0.09}}$≈3.33,
故答案為:3.33;
(2)該反應為放熱反應,升高溫度,平衡逆向移動,K減小,則450℃時的平衡常數大于500℃時的平衡常數,
故答案為:大于;
(3)A.保持容器的體積不變,當混合氣體的密度始終不變,不能判斷平衡,故A錯誤;
B.由質量守恒定律可知,混合氣體中硫元素的質量分數不變,故B錯誤;
C.達到平衡時若減小容器的體積,壓強增大,平衡正向移動,則正反應速率將大于逆反應速率,故C正確;
D.起始量之比不等于化學計量數之比,則二者轉化率不等,故D錯誤;
故答案為:C.
點評 本題考查化學平衡的計算,為高頻考點,把握化學平衡三段法、K的計算及平衡移動為解答本題的關鍵,側重分析與應用的考查,注意物質的量與熱量的關系,題目難度不大.


科目:高中化學 來源: 題型:選擇題
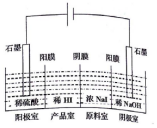 氫碘酸(HI)可用“四室式電滲析法”制備,其工作原理如圖所示(陽膜和陰膜分別只允許陽離子、陰離子通過).下列敘述錯誤的是( )
氫碘酸(HI)可用“四室式電滲析法”制備,其工作原理如圖所示(陽膜和陰膜分別只允許陽離子、陰離子通過).下列敘述錯誤的是( )| A. | 通電后,陰極室溶液pH增大 | |
| B. | 陽極電極反應式是2H2O-4e-═4H++O2↑ | |
| C. | 得到l mol產品HI,陽極室溶液質量減少8g | |
| D. | 通電過程中,NaI的濃度逐漸減小 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氨氣溶于水能導電,所以氨氣是電解質 | |
| B. | 硫粉在過量的純氧中燃燒可以生成SO2 | |
| C. | 用過量氨水除去Fe3+溶液中的少量Al3+ | |
| D. | 所有銨鹽受熱均可以分解,產物均有NH3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
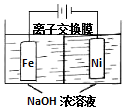 具有廣泛用途的Na2FeO4可用電解法制取:Fe+2H2O+2OH-$\frac{\underline{\;通電\;}}{\;}$FeO42-+3H2↑,其工作原理如圖所示.下列敘述正確的是( )
具有廣泛用途的Na2FeO4可用電解法制取:Fe+2H2O+2OH-$\frac{\underline{\;通電\;}}{\;}$FeO42-+3H2↑,其工作原理如圖所示.下列敘述正確的是( )| A. | 電解一段時間后,陽極室的c(OH-)增大 | |
| B. | Na+由陰極室移向陽極室 | |
| C. | 陰極反應式:2H2O+2e-=H2↑+2OH- | |
| D. | 電解過程中,當消耗1 mol OH-時,同時生成33.6 L H2 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 3mol C+1mol D | |
| B. | 1mol A+0.5mol B+1.5mol C+0.5mol D | |
| C. | 1mol A+0.5mol B+1.5mol C | |
| D. | 4mol A+2mol B |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
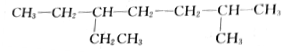 的名稱是2-甲基-5-乙基庚烷
的名稱是2-甲基-5-乙基庚烷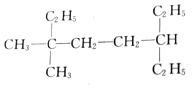 的名稱是3,3-二甲基-6-乙基辛烷
的名稱是3,3-二甲基-6-乙基辛烷 的名稱是2-甲基-3,6-二乙基辛烷
的名稱是2-甲基-3,6-二乙基辛烷 的名稱是2,4,4,5-四甲基庚烷.
的名稱是2,4,4,5-四甲基庚烷.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 等濃度CH3COOH溶液與NH3•H2O溶液等體積混合后,存在c(NH4+)+c(H+)=c(CH3COO-)+c(OH-) | |
| B. | 等濃度的HCl溶液與CH3COOH溶液中c(H+)也相同 | |
| C. | 向20mLHCl溶液中加入10mL同一濃度的HCl溶液時,其pH會改變 | |
| D. | 等濃度的CH3COOH溶液和NaOH溶液等體積混合后,溶液顯中性 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com