
【題目】氯化亞銅(CuCI)常用作有機合成工業中的催化劑,是一種白色粉末,微溶于水、不溶于乙醇及稀硫酸。工業上采用如下工藝流程,從某酸性廢液(主要含Cu2+、Fe3+、H+、CI-)中制備氯化亞銅。

請回答下列問題:
(1)寫出步驟①中發生的兩個主要反應的離子方程式:___。
(2)步驟②的操作名稱是___。
(3)步驟④中所加物質X為___。
(4)步驟⑤的操作是___。
(5)步驟⑥應調節溶液的pH呈酸性,且用乙醇洗滌CuCl品體,目的是___。
(6)在CuCI的生成過程中,可以循環利用的物質是___,理論上___(填“需要”或“不需要”)補充(不考慮調節等消耗);理由是___。
(7)エ業上還可以采用以碳棒為電極電解CuCl2溶液得到CuCl。寫出電解CuCl2溶液中的陰極上發生的電極反應:___。
【答案】Cu2++Fe=Cu+Fe2+、Fe+2Fe3+=3Fe2+或Fe+2H+=Fe2++H2↑ 過濾、洗滌 CuO或Cu(OH)2或CuCO3等 在HCl氣流中蒸發結晶 減少CuCl的損失 硫酸 不需要 Cu與濃硫酸反應生成CuSO4和SO2的物質的量為1:1,而生產CuCl的過程中消耗CuSO4和SO2的物質的量也為1﹕1,所以理論上不需要補充H2SO4 Cu2++Cl-+e-=CuCl↓
【解析】
從某酸性廢液(主要含Cu2+、Fe3+、H+、Cl-)中制備氯化亞銅,向工業上以某酸性廢液(含Cu2+、Fe3+、H+、Cl-)加入過量的鐵粉,三價鐵離子與鐵粉反應轉化為二價鐵離子,銅離子與鐵反應生成銅,然后過濾,濾渣為過量的鐵和生成的銅,依據銅與鐵活潑性,將濾渣溶于鹽酸,銅與鹽酸不反應,過濾得到濾渣即為銅,然后銅與濃硫酸反應生成硫酸銅和二氧化硫,酸性廢液調節pH值使鐵離子沉淀,過濾得氯化銅溶液,氯化銅、硫酸銅、二氧化硫反應生成氯化亞銅和硫酸,硫酸可以再循環利用。
(1)步驟①中鐵能與銅離子及鐵離子反應生成銅和亞鐵離子等,同時鐵也與酸性廢液中的酸反應生成氫氣,涉及的離子方程式為Cu2++Fe=Cu+Fe2+、Fe+2Fe3+=3Fe2+、Fe+2H+=Fe2++H2↑,故答案為:Cu2++Fe=Cu+Fe2+、Fe+2Fe3+=3Fe2+或Fe+2H+=Fe2++H2↑;
(2)步驟②中從溶液中分離出固體物質過量的鐵和生成的銅,所以步驟②的操作名稱是過濾、洗滌,故答案為:過濾、洗滌;
(3)步驟④中為調節溶液的pH值,要能與酸反應同時不引入新的雜質,所以物質X為CuO或Cu(OH)2或CuCO3等,故答案為:CuO或Cu(OH)2或CuCO3等;
(4)步驟⑤的操作是從氯化銅溶液中獲得氯化銅晶體,要防止銅離子水解,所以步驟⑤的操作是在HCl氣流中蒸發結晶,故答案為:在HCl氣流中蒸發結晶;
(5)CuCl微溶于水、不溶于乙醇及稀硫酸,所以要用乙醇洗滌CuCl晶體,減少CuCl的損失,故答案為:減少CuCl的損失;
(6)根據流程分析可知,硫酸可以循環利用,Cu與濃硫酸反應生成CuSO4和SO2的物質的量為1:1,而生產CuCl的過程中消耗CuSO4和SO2的物質的量也為1﹕1,所以理論上不需要補充H2SO4,故答案為:硫酸;不需要;Cu與濃硫酸反應生成CuSO4和SO2的物質的量為1:1,而生產CuCl的過程中消耗CuSO4和SO2的物質的量也為1﹕1,所以理論上不需要補充H2SO4;
(7)電解CuCl2溶液,陰極上是銅離子得電子生成亞銅離子,亞銅離子結合氯離子生成氯化亞銅沉淀,電極反應式為 Cu2++Cl-+e-=CuCl↓,故答案為:Cu2++Cl-+e-=CuCl↓。


科目:高中化學 來源: 題型:
【題目】硼酸(H3BO3)是一種重要的化工原料。工業上采用以硼鎂礦(含Mg2B2O5·H2O、SiO2及少量Fe2O3。Al2O3)為原料生產硼酸和輕質氧化鎂,其工藝流程如下:
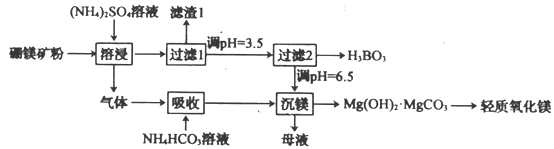
下列敘述錯誤的是
A.“溶浸”中產生的氣體是氨氣
B.“濾渣1”是SiO2
C.“過濾2”前,將溶液pH調節至3.5,目的是轉化為硼酸沉淀
D.“沉鎂”中得到的母液經加熱后可返回“溶浸”工序循環使用
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向100mL NaOH溶液中通入一定量的CO2后,在繼續向該溶液中逐滴加入0.2 mol·L-1的鹽酸,標準狀況下產生的CO2的體積與所加鹽酸體積之間的關系如下圖所示
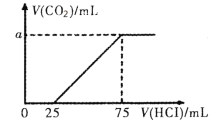
下列有關說法不正確的是
A.原溶液中NaOH的物質的量濃度為0.15 mol·L-1
B.0~25 mL發生的離子反應為:OH-+ H+ =H2O
C.通入CO2后所得的溶液中溶質的物質的量之比為1:1
D.縱坐標中a的數值為224
查看答案和解析>>
科目:高中化學 來源: 題型:
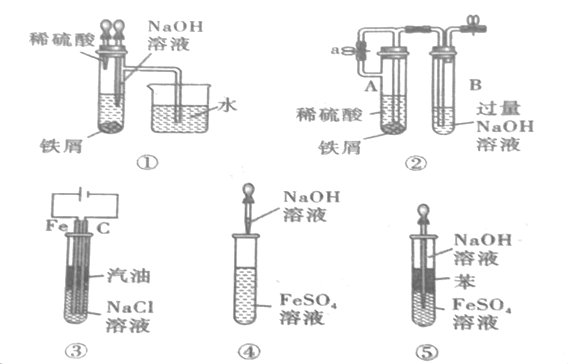
【題目】如圖所示,此裝置可用來制取和觀察Fe(OH)2在空氣中被被氧化的顏色變化。實驗時必須使用鐵屑和6molL-1的硫酸,其他試劑任選。填寫下列空白:

(1)B中盛有一定量的NaOH溶液,A中應預先加入的藥品是__。A中反應的離子方程式是__。
(2)實驗開始時先將活塞a__(填“打開”或“關閉”)。
(3)簡述生成Fe(OH)2的操作過程:__。
(4)實驗完畢,打開b處活塞,放入一部分空氣,此時B瓶中發生的反應為__。
(5)下列各圖示中,___能較長時間看到Fe(OH)2白色沉淀。(填序號)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列離子方程式書寫正確的是
A. 硫酸鋁溶液中滴加過量濃氨水:Al3+ + 4OH- = AlO![]() + 2H2O
+ 2H2O
B. NaHCO3溶液水解:HCO![]() + H2O = H2CO3 + OH-
+ H2O = H2CO3 + OH-
C. 濃氫氧化鈉溶液吸收少量SO2氣體:SO2+ 2OH- = SO![]() + H2O
+ H2O
D. 向小蘇打溶液中加入醋酸溶液:HCO![]() + H+= CO2↑+ H2O
+ H+= CO2↑+ H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列鹽溶液中能發生水解的用離子方程式表示,不能發生水解的請寫上“不發生水解”字樣并說明溶液的酸堿性:
(1)CH3COONa _____,溶液呈___性;
(2)BaCl2 ______,溶液呈______性;
(3)CuCl2 _____,溶液呈_____性。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Y形管是一種特殊的儀器,與其他儀器組合可以進行某些實驗探究。利用如圖裝置可以探究SO2與BaCl2反應生成BaSO3沉淀的條件。下列判斷正確的是

A. e、f兩管中的試劑可以分別是濃氨水和NaOH固體
B. 玻璃管的作用是連通大氣,使空氣中的氧氣進入廣口瓶,參與反應
C. c、d兩根導管都必須插入BaCl2溶液中,保證氣體與Ba2+充分接觸
D. Y形管乙中產生的為氧化性氣體,將BaSO3氧化為BaSO4沉淀
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室制Cl2的反應為4HCl(濃)+MnO2![]() MnCl2+Cl2↑+2H2O.下列說法錯誤的是( )
MnCl2+Cl2↑+2H2O.下列說法錯誤的是( )
A. 還原劑是HCl,氧化劑是MnO2
B. 每生成1 molCl2,轉移電子的物質的量為2 mol
C. 每消耗1 molMnO2,起還原劑作用的HCl消耗4mol
D. 生成的Cl2中,除含有一些水蒸氣外,還含有HCl雜質
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)2015年11月首架C919打飛機總裝下線,標志著我國躋身飛機研制先進國家行列。
①機身蒙皮使用的是第三代鋁鋰合金材料。下列不屬于鋁鋰合金性質的是___(填字母)。
a.密度大 b.硬度大 c.抗腐蝕
②飛機輪胎屬于橡膠制品。下列材料可用來合成橡膠的是____(填字母)。
a.石英砂 b.石灰石 c.異戊二烯
③機體先進復合材料的使用率達12%。下列屬于復合材料的是___(填字母)。
a.鈦合金 b.玻璃鋼 c.普通陶瓷
(2)秋葵是一種大眾喜愛的食材,含有蛋白質、維生素A、維生素C、纖維素、阿拉伯果糖和豐富的鐵、鋅、鈣等元素,其中:

①屬于人體所需微量元素的是____。
②屬于水溶性維生素的是____,屬于糖類的有阿拉伯果糖、___。
③蛋白質在人體內最終的水解產物是_____。
(3)化學能幫助我們更好地認識生活、改善生活。
①家用鐵鍋未洗凈晾干,放置一段時間后出現紅褐色銹斑,其主要的原因是鐵發生了____腐蝕。
②乘車禁止攜帶物品的部分標識如圖所示。在濃硝酸、食鹽、汽油、石膏四種物品中,不能攜帶上車的是_____。

③過氧乙酸(![]() )易分解為乙酸和氧氣,其稀溶常用于餐具、器械的消毒。寫出過氧乙酸分解的化學方程式______。某胃藥的主要成分是AlbMgc(OH)mCO3,常用于治療胃酸過多,寫出其中與胃酸反應的化學方程式_______。
)易分解為乙酸和氧氣,其稀溶常用于餐具、器械的消毒。寫出過氧乙酸分解的化學方程式______。某胃藥的主要成分是AlbMgc(OH)mCO3,常用于治療胃酸過多,寫出其中與胃酸反應的化學方程式_______。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com