
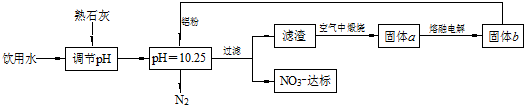
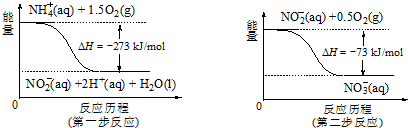
分析 根據流程圖知,pH=10.25時,Al和NO3-發生氧化還原反應生成氮氣,固體b是Al,電解熔融固體a得到Al,則A是Al2O3,濾渣在空氣中煅燒得到Al2O3,則濾渣為Al(OH)3,所以鋁粉和硝酸根離子在堿性條件下反應生成氮氣和Al(OH)3,其反應方程式為10Al+6NO3-+18H2O=10Al(OH)3+3N2↑+6OH-;
(1)Al具有兩性,能和強酸、強堿溶液反應;
(2)根據以上分析知,濾渣中一種成分是氫氧化鋁,因為反應中鋁過量,所以濾渣中還含有Al;
(3)用H2催化還原法也可降低飲用水中NO3-的濃度,反應中的還原產物和氧化產物均可參與大氣循環,則其產物是氮氣和水;
(4)由圖可知,第一步熱化學反應為NH4+ (aq)+1.5O2(g)=2H+(aq)+NO2- (aq)+H2O(l)△H=-273kJ•mol-1①,
第二步熱化學反應為NO2- (aq)+0.5O2(g)=NO3- (aq))△H=-73kJ•mol-1②,
由蓋斯定律書寫1mol NH4+(aq)全部氧化成NO3- (aq)的熱化學方程式.
解答 解:根據流程圖知,pH=10.25時,Al和NO3-發生氧化還原反應生成氮氣,固體b是Al,電解熔融固體a得到Al,則A是Al2O3,濾渣在空氣中煅燒得到Al2O3,則濾渣為Al(OH)3,所以鋁粉和硝酸根離子在堿性條件下反應生成氮氣和Al(OH)3,其反應方程式為10Al+6NO3-+18H2O=10Al(OH)3+3N2↑+6OH-;
(1)Al具有兩性,能和強酸、強堿溶液反應,所以該方案中選用熟石灰調節pH時,若pH過大或過小都會造成鋁的利用率降低,故答案為:Al;
(2)根據以上分析知,濾渣中一種成分是氫氧化鋁,因為反應中鋁過量,所以濾渣中還含有Al,所以濾渣成分為Al(OH)3 和Al,故答案為:Al(OH)3 和Al;
(3)用H2催化還原法也可降低飲用水中NO3-的濃度,反應中的還原產物和氧化產物均可參與大氣循環,則其產物是氮氣和水,離子方程式為5H2+2NO3-$\frac{\underline{\;催化劑\;}}{\;}$N2+4H2O+2OH-或5H2+2NO3-+2H+$\frac{\underline{\;催化劑\;}}{\;}$N2+6H2O,故答案為:5H2+2NO3-$\frac{\underline{\;催化劑\;}}{\;}$N2+4H2O+2OH-或5H2+2NO3-+2H+$\frac{\underline{\;催化劑\;}}{\;}$N2+6H2O;
(4)由圖可知,第一步熱化學反應為NH4+ (aq)+1.5O2(g)=2H+(aq)+NO2- (aq)+H2O(l)△H=-273kJ•mol-1①,
第二步熱化學反應為NO2- (aq)+0.5O2(g)=NO3- (aq))△H=-73kJ•mol-1②,
由蓋斯定律可知①+②得1mol NH4+(aq)全部氧化成NO3- (aq)的熱化學方程式為NH4+ (aq)+2O2(g)=2H+(aq)+NO3- (aq)+H2O(l)△H=-346 kJ•mol-1,
故答案為:NH4+ (aq)+2O2(g)=2H+(aq)+NO3- (aq)+H2O(l)△H=-346 kJ•mol-1.
點評 本題以信息的形式考查氧化還原反應、離子反應及熱化學反應、物質分離和提純,注重對化學用語的考查,注意知識與題目信息的結合來解答,根據生成物采用逆向思維分析解答,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | Na+、K+、Cl-、AlO2- | B. | Ba2+、NO3-、HCO3-、Br- | ||
| C. | Cu2+、K+、S2-、SO42- | D. | K+、SO32-、NO3-、MnO4- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①② | B. | ①②④ | C. | ①③④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 泡沫滅火器中用的是硫酸鋁和蘇打溶液,并且蘇打放在小塑料桶里. | |
| B. | 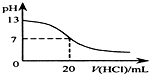 如圖表示25℃時,用0.1mol•L-1鹽酸滴定20mL0.1mol•L-1NaOH溶液,溶液的pH隨加入酸體積的變化 | |
| C. | 在常溫下用惰性電極電解足量食鹽水的實驗中,若電解后溶液總體積為0.5L,陰極析出的氣體的分子數為0.5NA,電解后溶液的pH為14 | |
| D. | 常溫時,濃度均為0.01mol/L Na2CO3溶液和NaHCO3溶液,等體積混合,其溶液中粒子濃度關系為2c(Na+)=3c(HCO3-)+3c(CO32-)+3c(H2CO3) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 試劑 | 離子反應方程式 | |
| ①Fe(Al) | ||
| ②FeCl 2溶液(FeCl3) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
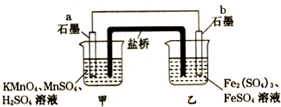 設計如圖原電池(2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O),鹽橋中裝有飽和溶液.下列說法正確的是( )
設計如圖原電池(2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O),鹽橋中裝有飽和溶液.下列說法正確的是( )| A. | 外電路電子的流向是從a到b | |
| B. | 電池工作時,鹽橋中的SO42-移向甲燒杯 | |
| C. | a電極上發生的反應為:MnO4-+8H++5e-═Mn2++4H2O | |
| D. | 雙液原電池工作時產生大量的熱量 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com