
| 時間/min 濃度/(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.3 0 | 0.36 | 0.36 |
| 溫度 | 時間/min 物質的量 | 0 | 10 | 20 | 40 | 50 |
| T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | x | 0.15 |
分析 (1)已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ/mol
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
由蓋斯定律[①+②-③×4]×$\frac{1}{2}$可得CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l);
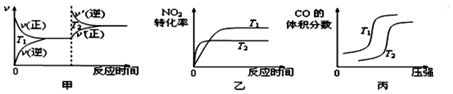
(2)該反應中焓變小于0,為放熱反應,升高溫度,正逆反應速率都增大,且反應向著逆向進行,二氧化氮轉化率減小、一氧化碳的體積含量減小,據此對各圖象進行判斷;
(3)①根據v=$\frac{△c}{△t}$計算反應速率,K=$\frac{c({N}_{2})•c(C{O}_{2})}{{c}^{2}(NO)}$計算化學平衡常數K;
②依據圖表數據分析,結合平衡濃度計算平衡常數和濃度變化分析判斷,30min后,只改變某一條件,反應重新達到平衡,C(s)+2NO(g)?N2(g)+CO2(g),依據圖表數據分析,平衡狀態物質濃度增大,依據平衡常數計算,平衡常數隨溫度變化,平衡常數不變說明改變的條件一定不是溫度;依據數據分析,氮氣濃度增大,二氧化碳和一氧化氮濃度增大,反應前后氣體體積不變,所以可能是減小溶液體積后加入一定量一氧化氮;
③若30min后升高溫度至T2℃,達到平衡時,容器中NO、N2、CO2的濃度之比從為2:1:1,氮氣和二氧化碳難度之比始終為1:1,所以2:1>4:3,說明平衡向逆反應方向移動;
(4)A、溫度升高,反應速率加快,甲烷剩余量增多,說明反應向左進行,正反應放熱;
B、溫度升高,反應速率加快,當溫度為T1、反應進行到40 min時已達平衡狀態,溫度為T2時反應也應該達到平衡狀態;
C、溫度為T2時,若向平衡后的容器中再充入0.50 mol CH4和1.2mol NO2,可等效為在另一個相同的容器中建立一個和原平衡相同的平衡狀態,再壓縮到一個容器中,即為增大壓強,平衡逆向移動;
D、根據溫度為T1時平衡常數不變,根據濃度商與平衡常數的大小判斷平衡移動方向,利用化學平衡三段式計算.
解答 解:(1)已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ/mol
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
由蓋斯定律[①+②-③×4]×$\frac{1}{2}$可得CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l)△H=-955 kJ/mol;
故答案為:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l)△H=-955 kJ/mol;
(2)該反應為放熱反應,升高溫度,正逆反應速率均增大,都應該離開原來的速率點,圖象與實際情況不相符,故甲錯誤;
升高溫度,反應向著逆向進行,反應物的轉化率減小,反應速率加快,圖象與實際反應一致,故乙正確;
壓強相同時,升高溫度,反應向著逆向移動,一氧化氮的體積分數應該增大,圖象與實際不相符,故丙錯誤;
故答案為:乙;
(3)①T1℃時,該反應在0-20min的平均反應速率v(NO)=$\frac{1mol/L-0.4mol/L}{20min}$=0.030mol•L-1•min-1;
C(s)+2NO(g)?N2(g)+CO2(g),平衡濃度c(N2)=0.3mol/L;c(CO2)=0.3mol/L;c(NO)=0.4mol/L;反應的平衡常數K=$\frac{0.3×0.3}{0.{4}^{2}}$=0.56;
故答案為:0.030mol•L-1•min-1;0.56;
②A.通入一定量的CO2,平衡逆向移動,NO的濃度增大,但是氮氣的濃度會減少,與題不符,故A錯誤;
B.催化劑只改變化學反應速率,不改變化學平衡,故B錯誤;
C.適當縮小容器的體積,反應前后體積不變,平衡狀態物質濃度增大,故C正確;
D.通入一定量的NO,新平衡狀態下物質平衡濃度增大,故D正確;
E.加入一定量的活性炭,碳是固體對平衡無影響,平衡不動,故E錯誤;
故答案為:CD;
③30min后升高溫度至T2℃,達到平衡時,容器中NO、N2、CO2的濃度之比從為2:1:1,氮氣和二氧化碳難度之比始終為1:1,所以2:1>4:3,說明平衡向逆反應方向移動,說明平衡向逆反應方向移動,達到新平衡時NO的轉化率,說明逆反應是吸熱反應,則正反應是放熱反應;
故答案為:降低;<;
(4)A、溫度升高,反應速率加快,因此T2>T1,甲烷剩余量增多,說明反應向左進行,正反應放熱,所以a<0,故A錯誤;
B、當溫度為T2、反應進行到40 min時,反應達到平衡狀態,x=0.15,故B錯誤;
C、溫度為T2時,若向平衡后的容器中再充入0.50 mol CH4和1.2mol NO2,平衡逆向移動,重新達到平衡時,n(N2)小于原平衡n(N2)的2倍,故C正確;
D、對于反應 CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(g)
起始(mol/L) 0.5 1.2 0 0 0
變化(mol/L) 0.4 0.8 0.4 0.4 0.8
平衡(mol/L) 0.1 0.4 0.4 0.4 0.8
溫度為T1時,平衡常數K=$\frac{0.{8}^{2}×0.4×0.4}{0.1×0.{4}^{2}}$=6.4,若起始時向容器中充入0.50 mol CH4(g)、0.50 molNO2(g)、1.0 mol N2(g)、2.0 molCO2(g)、0.50 molH2O(g),濃度商Qc=$\frac{0.{5}^{2}×2×1}{0.5×0.{5}^{2}}$=4<K,平衡正向移動,ν(正)>ν(逆),故D正確;
故答案為:CD.
點評 本題考查了蓋斯定律的應用、影響平衡移動的因素、平衡常數的有關計算等,綜合性較強,側重分析及計算能力的考查,把握化學平衡常數的有關計算為解答的關鍵,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | 常溫常壓下,20gH218O中含有中子數目為12NA | |
| B. | 標準狀況下,11.2LC2H6中含有極性鍵的數目為3.5NA | |
| C. | 1LpH=3的CH3COOH溶液中,含有H+的數目大于10-3NA | |
| D. | 1L1mol•L-1稀硝酸(還原產物為NO)與鐵完全反應,轉移電子數目為0.75NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| 物質 | 熔點/℃ | 沸點/℃ | 其他 |
| CCl4 | -23 | 76.8 | 與TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮濕空氣產生白霧 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 墨水是一種膠體,不同墨水混用時可能使鋼筆流水不暢或者堵塞 | |
| B. | 持續加熱到一定溫度能殺死甲型H1N1流感病毒是因為病毒的蛋白質受熱變性 | |
| C. | 潔廁液與84消毒液混合洗廁所可以達到洗滌和消毒殺菌的雙重功效,對人體不可能造成傷害 | |
| D. | 用13C示蹤原子法可以進行幽門螺旋桿菌的精確檢測 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 濃硫酸具有脫水性,因此實驗室可用濃硫酸與濃鹽酸制取少量HCl氣體 | |
| B. | 鈉是活潑金屬,可用電解NaCl溶液的方法獲得金屬鈉 | |
| C. | 碳酸鈉溶液顯堿性,用熱的碳酸鈉溶液可去除金屬表面的油污 | |
| D. | 在電熱水器的鋼鐵內膽中裝入銅棒可以防止內膽被腐蝕 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 三溴化鋁溶液 | B. | 偏鋁酸鈉溶液 | C. | 明礬溶液 | D. | 硝酸鋁溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
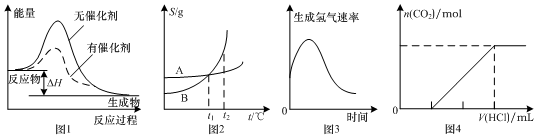
| A. | 圖1表示某放熱反應分別在有、無催化劑的情況下反應過程中的能量變化 | |
| B. | 圖2表示A、B兩物質的溶解度隨溫度變化情況,將t1℃時A、B的飽和溶液分別升溫至t2℃時,溶質的質量分數B>A | |
| C. | 圖3表示鎂條放入鹽酸中生成氫氣速率隨時間的變化,起初反應速率加快的原因可能是該反應為放熱反應 | |
| D. | 圖4表示在含等物質的量NaOH、Na2CO3的混合溶液中滴加0.1 mol•L-1鹽酸至過量時,產生氣體的體積與消耗鹽酸的關系 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| R | ||
| X | Y | Z |
| A. | 元素X的最高價氧化物對應水化物的化學式為H3PO4 | |
| B. | 元素Y有兩種常見的氧化物且都能與元素R的氫化物反應生成對應價態的酸 | |
| C. | R、X、Y三者的氣態氫化物穩定性依次增強 | |
| D. | Z的單質能與Y的某些化合物發生置換反應 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com