
在一定溫度下可逆反應N2+3H2 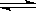 2NH3已達到平衡,下列有關說法正確的 ( )
2NH3已達到平衡,下列有關說法正確的 ( )
①1個N≡N鍵斷裂的同時,有3個H—H鍵形成
②反應混合物中各組分的體積分數保持不變
③恒溫恒容時,容器內的壓強不再改變
④1個N≡N鍵斷裂的同時,有3個N—H鍵形成
⑤NH3生成的速率與NH3分解的速率相等
⑥單位時間生成nmolN2,同時生成2nmolNH3
⑦氣體的平均相對分子質量不再改變
⑧N2H2NH3的分子數一定為1∶3∶2
⑨恒溫恒容時,氣體的總物質的量不再改變
⑩恒溫恒壓時,容器內的密度不再改變
A、①②③④⑤⑥⑦⑨ B、①②③⑤⑥⑩ C、③④⑤⑥⑦ ⑧ D、①②③⑤⑥⑦⑨⑩
科目:高中化學 來源:2015-2016學年廣西省高二上段考文化學試卷(解析版) 題型:選擇題
下列過程發生化學變化的是
A.酒香撲鼻 B.蠟燭照明 C.用金剛石切割玻璃 D.太陽能供熱
查看答案和解析>>
科目:高中化學 來源:2015-2016學年吉林省高一上期末(理)化學試卷(解析版) 題型:填空題
在2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O反應中,
(1)氧化劑是 ,氧化產物是 。
(2)被氧化與未被氧化的HCl的質量之比為 ,若有7.3gHCl被氧化,產生Cl2的體積(標況下)為 L,轉移電子 mol。
查看答案和解析>>
科目:高中化學 來源:2016屆河北省衡水市高三上一輪復習檢測一化學試卷(解析版) 題型:選擇題
向1LFeBr2溶液中,通入1.12L(標準狀況下)的Cl2,測得溶液中c(Br一)=3c(Cl一),反應過程中溶液的體積變化忽略不計,則下列說法中正確的是( )
A.原溶液的濃度為0.1mol/L B.反應后溶液中c(Fe3+)=0.1mol/L
C.反應后溶液中c(Fe3+)=c(Fe2+) D.原溶液中c(Br一)=0.4mol/L
查看答案和解析>>
科目:高中化學 來源:2016屆河北省衡水市高三上一輪復習檢測一化學試卷(解析版) 題型:選擇題
分類是科學研究的重要方法,下列物質分類不正確的是
A.化合物:干冰,冰水混合物,燒堿,小蘇打
B.非電解質:乙醇,四氯化碳,氯氣,葡萄糖
C.同素異形體:活性炭,C60,石墨烯,金剛石
D.混合物:鋁熱劑,純凈礦泉水,水玻璃,漂白粉
查看答案和解析>>
科目:高中化學 來源:2016屆陜西省高三上期末化學試卷(解析版) 題型:選擇題
某稀溶液中含有Fe(NO3)2、Cu(NO3)2、HNO3,向其中逐漸加入鐵粉,溶液中Fe2+的濃度與加入鐵粉的物質的量之間的關系如圖所示。則稀溶液中Fe(NO3)3、Cu(NO3)2、HNO3物質的量濃度之比為( )
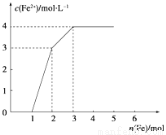
A.1:1:1 B.1:3:1 C.3:3:8 D.1:1:4
查看答案和解析>>
科目:高中化學 來源:2015-2016學年甘肅省高二上期末考試化學試卷(解析版) 題型:填空題
海水中蘊藏著豐富的資源,海水綜合利用的流程圖如下:
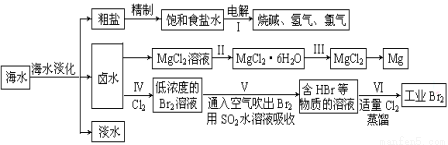
(一)某化學研究小組用右圖裝置模擬步驟I電解食鹽水(用鐵和石墨做電極)。
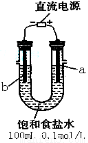
(1)a電極材料是 (填鐵、石墨),其電極反應式為 。
(2)當陰極產生11.2mL氣體時(標準狀況),該溶液的pH為 (忽略反應前后溶液體積的變化)。
(二)鹵水中蘊含著豐富的鎂資源,就MgCl2粗產品的提純、鎂的冶煉過程回答下列問題:已知MgCl2粗產品的溶液中含有Fe2+、Fe3+和Al3+。下表是生成氫氧化物沉淀的pH:
物質 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mg(OH)2 |
開始沉淀pH | 2.7 | 8.1 | 3.8 | 9.5 |
完全沉淀pH | 3.7 | 9.6 | 4.8 | 11.0 |
(3)把MgCl2粗產品的溶液中的Fe2+轉化為Fe3+,可選用的物質是______________(填序號,下同),加入
調節溶液的pH,充分反應后過濾,可得MgCl2溶液。
a.KMnO4 b.H2O2 c.MgO d.NaOH
(4)步驟Ⅲ由MgCl2·H2O獲得MgCl2的操作是: 。
(三)制取工業溴:
(5)步驟Ⅳ中已獲得Br2,步驟Ⅴ中又將Br2還原為Br-,其目的是 。
(6)寫出步驟Ⅴ用SO2水溶液吸收Br2的離子方程式: 。
查看答案和解析>>
科目:高中化學 來源:2015-2016學年黑龍江省高二上期末化學試卷(解析版) 題型:實驗題
(一)酸堿中和滴定是利用中和反應,用已知濃度的酸(或堿)來測定未知濃度的堿(或酸)的實驗方法。某學生用0.1032 mol·L-1的氫氧化鈉溶液滴定未知濃度的鹽酸溶液,其操作可分解為如下幾步:
(A)移取25.00mL待測的鹽酸溶液注入潔凈的錐形瓶,并加入2-3滴酚酞
(B)用標準溶液潤洗滴定管2-3次
(C)把盛有標準溶液的堿式滴定管固定好,調節液面使滴定管尖嘴充滿溶液
(D)取標準NaOH溶液注入堿式滴定管至0刻度以上2-3cm
(E)調節液面至0或0刻度以下,記下讀數
(F)把錐形瓶放在滴定管的下面,用標準KOH溶液滴定至終點,記下滴定管液面的刻度
完成以下填空:
(1)正確操作的順序是(用序號字母填寫)______________________。
(2)重復三次的實驗數據如下表所示:
實驗序號 | 消耗0.1032 mol·L-1的氫氧化鈉溶液的體積/mL | 待測鹽酸溶液的體積/mL |
1 | 28.84 | 25.00 |
2 | 27.83 | 25.00 |
3 | 27.85 | 25.00 |
則待測HCl的物質的量濃度是________mol·L-1。
(3)滴定至終點的現象是 。
(4)下列操作中可能使所測鹽酸的濃度數值偏低的是 。
A.堿式滴定管未用標準溶液潤洗就直接注入標準液
B.滴定前盛放鹽酸的錐形瓶用蒸餾水洗凈后沒有干燥
C.堿式滴定管在滴定前有氣泡,滴定后氣泡消失
D.讀取氫氧化鈉溶液體積時,開始仰視讀數,滴定結束時俯視讀數
(5)若用同濃度的氨水與同濃度的鹽酸混合至二者恰好完全中和時,該溶液中離子濃度大小關系為 。
(二)從海水中提取溴的工業流程如圖:
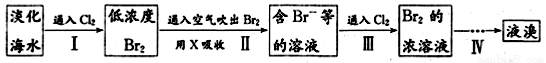
(1)以上步驟Ⅰ中已獲得游離態的溴,步驟Ⅱ又將之轉變成化合態的溴,其目的是 。
(2)上述流程中吹出的溴蒸氣,也可先用二氧化硫水溶液吸收,再用氯氣氧化后蒸餾。寫出溴與二氧化硫水溶液反應的化學方程式: 。
查看答案和解析>>
科目:高中化學 來源:2016屆江蘇省高三上學期第二次質檢化學試卷(解析版) 題型:選擇題
在3個2 L的密閉容器中,在相同的溫度下、使用相同的催化劑分別進行反應:
3H2(g)+N2(g)  2NH3(g)。按不同方式投入反應物,保持恒溫、恒容,測得反應達到平衡時有關數據如下:
2NH3(g)。按不同方式投入反應物,保持恒溫、恒容,測得反應達到平衡時有關數據如下:

下列說法正確的是
A.容器乙中反應從開始到達平衡的反應速率為v(H2)=1.5mol·L-1·min-1
B.2c1<1.5
C.2ρ1=ρ2
D. 在該溫度下甲容器中反應的平衡常數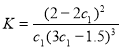
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com