
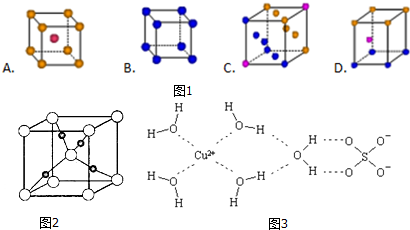
 .
.分析 (1)Cu的原子序數為29,結合能量最低原理書寫電子排布式;Cu為最密堆積,配位數為12;
(2)CO與N2為等電子體,根據N2的結構判斷;
(3)①甲醇中含有氫鍵,沸點較高,中心原子形成3個δ鍵;
②根據價層電子對互斥模型判斷,分子中單鍵為δ鍵,雙鍵中一個δ鍵,一個為π鍵;
③利依據晶胞示意圖可以看出Cu原子處于晶胞內部,以此判斷銅原子數;
(4)①Cu2+提供空軌道,水中氧原子提供孤對電子,形成配位鍵;
②氫鍵較一般分子間作用力強,影響物質的物理性質;
解答 解:(1)①Cu的原子序數為29,電子排布式為1s22s22p63s23p63d104s1或[Ar]3d104s1,②Cu為最密堆積,配位數為12,C符合,
故答案為:①1s22s22p63s23p63d104s1或[Ar]3d104s1;②C;
(2)依據等電子原理,可知CO與N2為等電子體,N2分子的結構式為:N≡N,互為等電子體分子的結構相似,可寫出CO的結構式為C≡O,
故答案為:C≡O;
(3)①甲醇分子之間形成了分子間氫鍵,甲醛分子間只是分子間作用力,而沒有形成氫鍵,故甲醇的沸點高,甲醛分子中含有碳氧雙鍵,故碳原子軌道的雜化類型為sp2雜化,故答案為:甲醇分子之間形成氫鍵;sp2雜化;
②甲醛為sp2雜化,不含孤電子對,分子的空間構型為平面三角形;1mol甲醛分子中含有2mol碳氫δ鍵,1mol碳氧δ鍵,故含有δ鍵的物質的量為3mol,數目為3NA個;
故答案為:平面三角形;3NA;
③依據晶胞示意圖可以看出Cu原子處于晶胞內部,所包含的Cu原子數目為4,
故答案為:4;
(4)①Cu2+提供空軌道,水中氧原子提供孤對電子,形成配位鍵,水合銅離子的結構簡式為: ,
,
故答案為: ;
;
②氫鍵較一般分子間作用力強,所以水的熔、沸點較高,由于氫鍵具有方向性,結冰時,氫鍵增多,體積增大,密度減小,
故答案為:水的熔、沸點較高;結冰時密度減小.
點評 本題把原子結構、分子結構及晶體結構、配合物知識較好地融合在一起,綜合考查了物質結構與性質的主干知識,題目難度中等.


 一諾書業暑假作業快樂假期云南美術出版社系列答案
一諾書業暑假作業快樂假期云南美術出版社系列答案科目:高中化學 來源: 題型:選擇題
| A. | 一定條件下,Cl2可在甲苯的苯環或側鏈上發生取代反應 | |
| B. | 光照下2,2二甲基丙烷與Br2反應,其一溴取代物只有一種 | |
| C. | 乙烷和丙烯的物質的量共1 mol,完全燃燒生成3 mol H2O | |
| D. | 次氯酸鈉溶液中通入CO2生成次氯酸,則碳酸的酸性比次氯酸弱 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
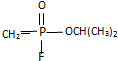 .已知
.已知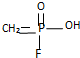 的名稱為甲氟磷酸,則“沙林”的化學名稱為( )
的名稱為甲氟磷酸,則“沙林”的化學名稱為( )| A. | 甲氟磷酸異丙醚 | B. | 甲氟磷酸異丙酯 | ||
| C. | 甲基異丙基氟磷酸 | D. | 甲氟異丙氧基磷酸 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 做銀鏡反應后的試管用氨水洗滌 | |
| B. | 做碘升華實驗后的燒杯用酒精洗滌 | |
| C. | 盛裝苯酚后的試管用鹽酸洗滌 | |
| D. | 收集完乙酸乙酯的試管用碳酸鈉溶液洗滌 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
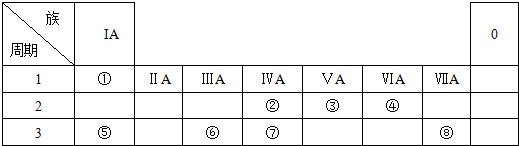
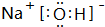
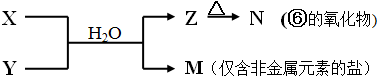
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 4 | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 加入一定體積的NaCl溶液 | B. | 加入一定體積的KNO3飽和溶液 | ||
| C. | 加入少量的Na2CO3固體 | D. | 加入少量的CuSO4固體 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com