
下列有關0.1 mol/L NaHCO3溶液中粒子濃度關系式正確的是
A.c(Na+)>c(HCO3-)>c(CO32-)>c(H+)>c(OH-)
B.c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
C.c(Na+)= c(HCO3-)+ 2c(CO32-)+ c(H2CO3)
D.c(Na+)+ c(H+)= c(HCO3-)+2c(CO32-) + c(OH-)
D
【解析】
試題分析:
A.c(Na+)>c(HCO3-)>c(CO32-)>c(H+)>c(OH-) 溶液顯示堿性,所以氫離子的濃度一定小于氫氧根的濃度;
B.c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+)溶液顯示堿性,說明碳酸氫根的水解程度大于碳酸氫根的電離程度,所以,碳酸氫根的濃度大于碳酸鈣的濃度;
C.c(Na+)= c(HCO3-)+ 2c(CO32-)+ c(H2CO3)是電荷守恒和物料守恒的雜糅,錯誤;
D.c(Na+)+ c(H+)= c(HCO3-)+2c(CO32-) + c(OH-)是電荷守恒,正確,故選D。
考點:電荷守恒 質子守恒 物料守恒
點評:
1、所謂電荷守恒是指溶液中所有陽離子所帶的正電荷總數與所有陰離子所帶的負電荷總數相等。
2、快速書寫質子守恒的方法:
第一步:盯基準物 (若為溶液則包括水)利用電離和水解得到 得質子產物和失質子產物。
第二步:看基準物 、得質子產物和失質子產物相差的質子數
第三步: 列出質子守恒關系式 得質子數=失質子數
第四步:用物料守恒和電荷守恒加以驗證
3、物料守恒可以理解為原子守恒的另一種說法。就是說“任一化學反應前后原子種類(指原子核中質子數相等的原子,就是元素守恒)和數量分別保持不變”,可以微觀地應用到具體反應方程式,就是左邊帶電代數和等于右邊。其中的也可以理解為原子核,因為外圍電子數可能有變,這時候可以結合電荷守恒來判斷問題。可以微觀地應用到具體反應方程式,就是左邊(反應物)元素原子(核)個數種類與總數對應相等于右邊(生成物)(當然也不會出現種類不同的情況)。


 新思維寒假作業系列答案
新思維寒假作業系列答案科目:高中化學 來源: 題型:閱讀理解
(12分)本題包括A、B兩小題,分別對應于“物質結構與性質”和“實驗化學”兩個選修模塊的內容。請選定其中一題,并在相應的答題區域內作答。若兩題都做,則按A題評分。
A.用于合成氨的工業煤氣中含有H2S、C2H5SH(乙酸醇)、COS(羰基硫)、CS2等含硫化合物,工業上無機硫常用氧化鋅法處理,有機硫可用鈷鉬催化加氫處理。
H2S+ZnO=ZnS+H2O;C2H5SH+ZnO=ZnS+C2H4+H2O
C2H5SH+H2=C2H6+H2S;COS+H2=CO+H2S;CS2+4H2=CH4+2H2S
(1)鈷原子在基態時核外電子排布式為 。
(2)下列有關分子結構的說法正確的是 。
A.C2H4分子中有5個![]() 鍵處1個
鍵處1個![]() 鍵
鍵
B.COS分子(結構如右圖)中鍵能C=O>C=S
C.H2S分子呈V形結構
D.CH4、C2H6分子中碳原子均采用sp3雜化
(3)下列有關說法不正確的是 。
A.H2O、CO、COS均是極性分子
B.相同壓強下沸點:Cs2>COS>CO2
C.相同壓強下沸點:C2H5SH>C2H5OH
D.相同壓強下沸點:CO>N2
(4)![]() -ZnS的晶胞結構如右圖,晶胞中S2-數目為: 個。
-ZnS的晶胞結構如右圖,晶胞中S2-數目為: 個。
(5)具有相似晶胞結構的ZnS和ZnO,ZnS熔點為1830℃,ZnO熔點為1975℃,后者較前者高是由于 。
(6)鉬的一種配合物化學式為:Na3[Mo(CN)8]·8H2O,中心原子的配位數為 。
B.烴醛結合反應有機合成中頗為重要,綠色催化劑的固體鈮酸酸倍受研究者關注。鈮酸具有較高的催化活性及穩定性。反應原理如下:
實驗方法是在25mL燒瓶中加入鈮酸、10mL甲醇和 0.5mL苯甲醛,在回流狀態下反應2h,反應的產率和轉化率均非常高。
(1)采用回流反應2h的目的是 。
(2)在反應中甲醇需過量,其原因是 。
(3)不同鈮酸用量對產率和轉化率影響,如下表:
| 鈮酸用量/mol | 0.01 | 0.02 | 0.03 | 0.05 | 0.1 | 0.15 | 0.2 | 0.6 |
| 產率% | 87.3 | 88.2 | 90.3 | 94.2 | 92.9 | 93.1 | 91.8 | 92.3 |
| 轉化率% | 89.7 | 92.1 | 93.9 | 98.9 | 94.9 | 95.7 | 93.9 | 94.3 |
在上述苯甲醛與甲醇縮合反應實驗中催化劑鈮酸的最佳用量為 。
(4)催化劑的回收利用性能是考察催化劑的一項極為重要的指標。鈮酸催化劑循環使用次數對產率的影響如右下圖,這說明鈮酸催化劑的優點之一是 。
(5)用鈮酸作催化劑時,不同的醛與甲醇的縮合反應的轉化率和產率如下表:
| 序號 | 醛 | 醇 | 轉化率% | 產率% |
| 1 | 鄰羥基苯甲醛 | 甲醇 | 94.3 | 89.6 |
| 2 | 鄰羥基苯甲醛 | 甲醇 | 93.6 | 88.7 |
| 3 | 鄰氯苯甲醛 | 甲醇 | 93.1 | 87.3 |
| 4 | 間硝基苯甲醛 | 甲醇 | 54.2 | 34.1 |
| 5 | 鄰硝基苯甲醛 | 甲醇 | 89.9 | 79.5 |
| 6 | 對硝基苯甲醛 | 甲醇 | 65.7 | 41.9 |
從表中得出的不同的醛與甲醇縮合反應影響轉化率和產率的規律是 。
查看答案和解析>>
科目:高中化學 來源:2010年江蘇省鹽城市高三上學期摸底考試化學試題 題型:填空題
(12分)本題包括A、B兩小題,分別對應于“物質結構與性質”和“實驗化學”兩個選修模塊的內容。請選定其中一題,并在相應的答題區域內作答。若兩題都做,則按A題評分。
A.用于合成氨的工業煤氣中含有H2S、C2H5SH(乙酸醇)、COS(羰基硫)、CS2等含硫化合物,工業上無機硫常用氧化鋅法處理,有機硫可用鈷鉬催化加氫處理。
H2S+ZnO=ZnS+H2O;C2H5SH+ZnO=ZnS+C2H4+H2O
C2H5SH+H2=C2H6+H2S;COS+H2=CO+H2S;CS2+4H2=CH4+2H2S
(1)鈷原子在基態時核外電子排布式為 。
(2)下列有關分子結構的說法正確的是 。
A.C2H4分子中有5個 鍵處1個
鍵處1個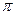 鍵
鍵
B.COS分子(結構如右圖)中鍵能C=O>C=S
C.H2S分子呈V形結構
D.CH4、C2H6分子中碳原子均采用sp3雜化
(3)下列有關說法不正確的是 。
A.H2O、CO、COS均是極性分子
B.相同壓強下沸點:Cs2>COS >CO2
>CO2
C.相同壓強下沸點:C2H 5SH>C2H5OH
5SH>C2H5OH
D.相同壓強下沸點:CO>N2
(4) -ZnS的晶胞結構如右圖,晶胞中S2-數目為: 個。
-ZnS的晶胞結構如右圖,晶胞中S2-數目為: 個。
(5)具有相似晶胞結構的ZnS和ZnO,ZnS熔點為1830℃,ZnO熔點為1975℃,后者較前者高是由于 。
(6)鉬的一種配合物化學式為:Na3[Mo(CN)8]·8H2O,中心原子的配位數為 。
B.烴醛結合反應有機合成中頗為重要,綠色催化劑的固體鈮酸酸倍受研究者關注。鈮酸具有較高的催化活性及穩定性。反應原理如下:
實驗方法是在25mL燒瓶中加入鈮酸、10mL甲醇和 0.5mL苯甲醛,在回流狀態下反應2h,反應的產率和轉化率均非常高。
(1)采用回流反應2h的目的是 。
(2)在反應中甲醇需過量,其原因是 。 (3)不同鈮酸用量對產率和轉化率影響,如下表:
(3)不同鈮酸用量對產率和轉化率影響,如下表:
| 鈮酸用量/mol | 0.01 | 0.02 | 0.03 | 0.05 | 0.1 | 0.15 | 0.2 | 0.6 |
| 產率% | 87.3 | 88.2 | 90.3 | 94.2 | 92.9 | 93.1 | 91.8 | 92.3 |
| 轉化率% | 89.7 | 92.1 | 93.9 | 98.9 | 94.9 | 95.7 | 93.9 | 94.3 |
| 序號 | 醛 | 醇 | 轉化率% | 產率% |
| 1 | 鄰羥基苯甲醛 | 甲醇 | 94.3 | 89.6 |
| 2 | 鄰羥基苯甲醛 | 甲醇 | 93.6 | 88.7 |
| 3 | 鄰氯苯甲醛 | 甲醇 | 93.1 | 87.3 |
| 4 | 間硝基苯甲醛 | 甲醇 | 54.2 | 34.1 |
| 5 | 鄰硝基苯甲醛 | 甲醇 | 89.9 | 79.5 |
| 6 | 對硝基苯甲醛 | 甲醇 | 65.7 | 41.9 |

查看答案和解析>>
科目:高中化學 來源:2010年江蘇省鹽城市高三上學期摸底考試化學試題 題型:填空題
(12分)本題包括A、B兩小題,分別對應于“物質結構與性質”和“實驗化學”兩個選修模塊的內容。請選定其中一題,并在相應的答題區域內作答。若兩題都做,則按A題評分。
A.用于合成氨的工業煤氣中含有H2S、C2H5SH(乙酸醇)、COS(羰基硫)、CS2等含硫化合物,工業上無機硫常用氧化鋅法處理,有機硫可用鈷鉬催化加氫處理。
H2S+ZnO=ZnS+H2O;C2H5SH+ZnO=ZnS+C2H4+H2O
C2H5SH+H2=C2H6+H2S;COS+H2=CO+H2S;CS2+4H2=CH4+2H2S
(1)鈷原子在基態時核外電子排布式為 。
(2)下列有關分子結構的說法正確的是 。
A.C2H4分子中有5個 鍵處1個
鍵處1個 鍵
鍵
B.COS分子(結構如右圖)中鍵能C=O>C=S
C.H2S分子呈V形結構
D.CH4、C2H6分子中碳原子均采用sp3雜化
(3)下列有關說法不正確的是 。
A.H2O、CO、COS均是極性分子
B.相同壓強下沸點:Cs2>COS>CO2
C.相同壓強下沸點:C2H5SH>C2H5OH
D.相同壓強下沸點:CO>N2
(4)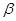 -ZnS的晶胞結構如右圖,晶胞中S2-數目為: 個。
-ZnS的晶胞結構如右圖,晶胞中S2-數目為: 個。

(5)具有相似晶胞結構的ZnS和ZnO,ZnS熔點為1830℃,ZnO熔點為1975℃,后者較前者高是由于 。
(6)鉬的一種配合物化學式為:Na3[Mo(CN)8]·8H2O,中心原子的配位數為 。
B.烴醛結合反應有機合成中頗為重要,綠色催化劑的固體鈮酸酸倍受研究者關注。鈮酸具有較高的催化活性及穩定性。反應原理如下:

實驗方法是在25mL燒瓶中加入鈮酸、10mL甲醇和 0.5mL苯甲醛,在回流狀態下反應2h,反應的產率和轉化率均非常高。
(1)采用回流反應2h的目的是 。
(2)在反應中甲醇需過量,其原因是 。
(3)不同鈮酸用量對產率和轉化率影響,如下表:
|
鈮酸用量/mol |
0.01 |
0.02 |
0.03 |
0.05 |
0.1 |
0.15 |
0.2 |
0.6 |
|
產率% |
87.3 |
88.2 |
90.3 |
94.2 |
92.9 |
93.1 |
91.8 |
92.3 |
|
轉化率% |
89.7 |
92.1 |
93.9 |
98.9[來源:Zxxk.Com] |
94.9 |
95.7 |
93.9 |
94.3 |
在上述苯甲醛與甲醇縮合反應實驗中催化劑鈮酸的最佳用量為 。
(4)催化劑的回收利用性能是考察催化劑的一項極為重要的指標。鈮酸催化劑循環使用次數對產率的影響如右下圖,這說明鈮酸催化劑的優點之一是 。
(5)用鈮酸作催化劑時,不同的醛與甲醇的縮合反應的轉化率和產率如下表:
|
序號 |
醛 |
醇 |
轉化率% |
產率% |
|
1 |
鄰羥基苯甲醛 |
甲醇 |
94.3 |
89.6 |
|
2 |
鄰羥基苯甲醛 |
甲醇 |
93.6 |
88.7 |
|
3 |
鄰氯苯甲醛 |
甲醇 |
93.1 |
87.3 |
|
4 |
間硝基苯甲醛 |
甲醇 |
54.2 |
34.1 |
|
5 |
鄰硝基苯甲醛 |
甲醇 |
89.9 |
79.5 |
|
6 |
對硝基苯甲醛 |
甲醇 |
65.7 |
41.9 |

從表中得出的不同的醛與甲醇縮合反應影響轉化率和產率的規律是 。
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
本題包括A、B兩小題,分別對應于“物質結構與性質”和“實驗化學”兩個選修模塊的內容。請選定其中一題,并在相應的答題區域內作答。若兩題都做,則按A題評分。
A.用于合成氨的工業煤氣中含有H2S、C2H5SH(乙酸醇)、COS(羰基硫)、CS2等含硫化合物,工業上無機硫常用氧化鋅法處理,有機硫可用鈷鉬催化加氫處理。
H2S+ZnO=ZnS+H2O;C2H5SH+ZnO=ZnS+C2H4+H2O
C2H5SH+H2=C2H6+H2S;COS+H2=CO+H2S;CS2+4H2=CH4+2H2S
(1)鈷原子在基態時核外電子排布式為 。
(2)下列有關分子結構的說法正確的是 。
A.C2H4分子中有5個![]() 鍵處1個
鍵處1個![]() 鍵
鍵
B.COS分子(結構如右圖)中鍵能C=O>C=S
C.H2S分子呈V形結構
D.CH4、C2H6分子中碳原子均采用sp3雜化
(3)下列有關說法不正確的是 。
A.H2O、CO、COS均是極性分子
B.相同壓強下沸點:Cs2>COS>CO2
C.相同壓強下沸點:C2H5SH>C2H5OH
D.相同壓強下沸點:CO>N2
(4)![]() -ZnS的晶胞結構如右圖,晶胞中S2-數目為: 個。
-ZnS的晶胞結構如右圖,晶胞中S2-數目為: 個。

(5)具有相似晶胞結構的ZnS和ZnO,ZnS熔點為1830℃,ZnO熔點為1975℃,后者較前者高是由于 。
(6)鉬的一種配合物化學式為:Na3[Mo(CN)8]·8H2O,中心原子的配位數為 。
B.烴醛結合反應有機合成中頗為重要,綠色催化劑的固體鈮酸酸倍受研究者關注。鈮酸具有較高的催化活性及穩定性。反應原理如下:

實驗方法是在25mL燒瓶中加入鈮酸、10mL甲醇和 0.5mL苯甲醛,在回流狀態下反應2h,反應的產率和轉化率均非常高。
(1)采用回流反應2h的目的是 。
(2)在反應中甲醇需過量,其原因是 。
(3)不同鈮酸用量對產率和轉化率影響,如下表:
| 鈮酸用量/mol | 0.01 | 0.02 | 0.03 | 0.05 | 0.1 | 0.15 | 0.2 | 0.6 |
| 產率% | 87.3 | 88.2 | 90.3 | 94.2 | 92.9 | 93.1 | 91.8 | 92.3 |
| 轉化率% | 89.7 | 92.1 | 93.9 | 98.9 | 94.9 | 95.7 | 93.9 | 94.3 |
在上述苯甲醛與甲醇縮合反應實驗中催化劑鈮酸的最佳用量為 。
(4)催化劑的回收利用性能是考察催化劑的一項極為重要的指標。鈮酸催化劑循環使用次數對產率的影響如右下圖,這說明鈮酸催化劑的優點之一是 。
(5)用鈮酸作催化劑時,不同的醛與甲醇的縮合反應的轉化率和產率如下表:
| 序號 | 醛 | 醇 | 轉化率% | 產率% |
| 1 | 鄰羥基苯甲醛 | 甲醇 | 94.3 | 89.6 |
| 2 | 鄰羥基苯甲醛 | 甲醇 | 93.6 | 88.7 |
| 3 | 鄰氯苯甲醛 | 甲醇 | 93.1 | 87.3 |
| 4 | 間硝基苯甲醛 | 甲醇 | 54.2 | 34.1 |
| 5 | 鄰硝基苯甲醛 | 甲醇 | 89.9 | 79.5 |
| 6 | 對硝基苯甲醛 | 甲醇 | 65.7 | 41.9 |

從表中得出的不同的醛與甲醇縮合反應影響轉化率和產率的規律是 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com