
【題目】氫氣是一種清潔能源.制氫和儲氫作為氫能利用的關鍵技術,是當前科學家主要關注的熱點問題.
(1)用甲烷制取氫氣的兩步反應的能量變化如圖所示: 
①甲烷和水蒸氣反應生成二氧化碳和氫氣的熱化學方程式是 .
②第Ⅱ步反應為可逆反應.800℃時,若CO的起始濃度為2.0molL﹣1 , 水蒸氣的起始濃度為3.0molL﹣1 , 達到化學平衡狀態后,測得CO2的濃度為1.2molL﹣1 , 則CO的平衡轉化率為 .
(2)NaBH4是一種重要的儲氫載體,能與水反應生成NaBO2 , 且反應前后B元素的化合價不變,該反應的化學方程式為 , 反應消耗1mol NaBH4時轉移的電子數目為 .
(3)儲氫還可借助有機物,如利用環已烷和苯之間的可逆反應來實現脫氫和加氫. 
在某溫度下,向恒容容器中加入環已烷,其起始濃度為a molL﹣1 , 平衡時苯的濃度為b molL﹣1 , 該反應的平衡常數K=(用含a、b的關系式表達).
【答案】
(1)CH4(g)+2H2O(g)=4H2(g)+CO2(g)△H=﹣136.5kJ/mol;60%
(2)NaBH4+2H2O=NaBO2+4H2↑;4NA或2.408×1024
(3)![]() mol3?L﹣3
mol3?L﹣3
【解析】解:(1)①根據第一步反應過程可以得出:CH4(g)+H2O(g)=3H2(g)+CO(g),△H=﹣103.3KJ/mol;
根據第二步反應過程可以得出:CO(g)+H2O(g)=H2(g)+CO2(g),△H=﹣33.2KJ/mol;
根據蓋斯定律,上下兩式相加可得:CH4(g)+2H2O(g)=4H2(g)+CO2(g)△H=﹣136.5 kJ/mol,
所以答案是:CH4(g)+2H2O(g)=4H2(g)+CO2(g)△H=﹣136.5 kJ/mol;
②設CO的平衡轉化量為x,
CO(g)+ | H2O(g)= | H2(g)+ | CO2(g) | |
初始濃度: | 2.0 | 3.0 | 0 | 0 |
變化濃度: | 1.2 | 1.2 | 1.2 | 1.2 |
平衡濃度: | 0.8 | 0.8 | 1.2 | 1.2 |
則CO的平衡轉化率為 ![]() ×100%=60%,
×100%=60%,
所以答案是:60%;(2)NaBH4與水反應生成NaBO2 , 且反應前后B的化合價不變,NaBO2中B元素化合價為+3價,所以NaBH4中H元素的化合價為﹣1價,所以H元素化合價由﹣1價、+1價變為0價,再結合轉移電子守恒配平方程式為NaBH4+2H2O=NaBO2+4H2↑,反應消耗1mol NaBH4時轉移的物質的量=1mol×4×(1﹣0)=4mol,所以轉移電子數為4NA或2.408×1024 , 所以答案是:NaBH4+2H2O=NaBO2+4H2↑;4NA或2.408×1024;(3)環己烷的起始濃度為amolL﹣1 , 平衡時苯的濃度為bmolL﹣1 , 同一容器中各物質反應的物質的量濃度之比等于其計量數之比,所以根據方程式知,環己烷的平衡濃度為(a﹣b)mol/L,氫氣的濃度為3bmol/L,則平衡常數K= ![]() mol3L﹣3=
mol3L﹣3= ![]() =
= ![]() mol3L﹣3 ,
mol3L﹣3 ,
所以答案是: ![]() mol3L﹣3 .
mol3L﹣3 .
【考點精析】利用化學平衡的計算對題目進行判斷即可得到答案,需要熟知反應物轉化率=轉化濃度÷起始濃度×100%=轉化物質的量÷起始物質的量×100%;產品的產率=實際生成產物的物質的量÷理論上可得到產物的物質的量×100%.


 南大教輔搶先起跑暑假銜接教程南京大學出版社系列答案
南大教輔搶先起跑暑假銜接教程南京大學出版社系列答案科目:高中化學 來源: 題型:
【題目】如圖是用0.1000mol/L的鹽酸滴定某未知濃度的NaOH溶液的示意圖和某次滴定前、后的盛放鹽酸滴定管中液面的位置.請回答:
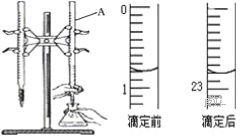
(1)儀器A的名稱是__________________;
(2)鹽酸的體積讀數:滴定前讀數為_____mL,滴定后讀數為______mL;
(3)某實驗小組同學的三次實驗的實驗數據如下表所示.根據表中數據計算出的待測NaOH溶液的濃度是________________;(保留四位有效數字)
實驗 編號 | 待測NaOH溶液的體積(mL) | 滴定前鹽酸的 體積讀數mL) | 滴定后鹽酸的 體積讀數(mL) |
1 | 20.00 | 1.20 | 23.22 |
2 | 20.00 | 2.21 | 24.21 |
3 | 20.00 | 1.50 | 23.48 |
(4)滴定操作可分解為如下幾步(所用的儀器剛用蒸餾水洗凈):
A.用堿式滴定管向錐形瓶里注入20.00mL待測NaOH溶液,并加入2~3滴酚酞;
B.用標準溶液潤洗酸式滴定管2~3次;
C.把盛有標準溶液的酸式滴定管固定好,調節滴定管尖嘴使之充滿溶液,使管內無氣泡;
D.取標準鹽酸注入酸式滴定管至刻度0以上2~3cm;
E.調節液面至0或0以下刻度,記下讀數;
F.把錐形瓶放在滴定管的下面,用標準鹽酸滴定至終點并記下滴定管液面的刻度。
正確操作步驟的順序是(用序號字母填寫)_____________;
(5)判斷到達滴定終點的實驗現象是________________________________。
(6)對下列幾種假定情況進行討論:(填“無影響”、“偏高”、“偏低”)
①如果上述B步驟省略,對測定結果的影響是_________;
②取待測液的滴定管,滴定前滴定管尖端有氣泡,滴定后氣泡消失._________;
③若滴定前錐形瓶未用待測液潤洗,對測定結果的影響是___________;
④標準液讀數時,若滴定前仰視,滴定后俯視,對測定結果的影響是___________.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有一瓶乙二醇和丙三醇的混和物,已知它們的性質如下表,據此,將乙二醇和丙三醇互相分離的最佳方法是( )
物質 | 分子式 | 熔點℃ | 沸點℃ | 密度(g/cm3) | 溶解性 |
乙二醇 | C2H6O2 | -11.5 | 198 | 1.11 | 易溶于水和乙醇 |
丙三醇 | C3H8O3 | 17.9 | 290 | 1.26 | 能跟水、酒精以任意比互溶 |
A.結晶法B.萃取法C.分液法D.蒸餾法
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】同體積同物質的量濃度的AgNO3溶液中分別加入同體積的NaCl、MgCl2、AlCl3溶液,恰好使Cl-完全轉化為沉淀,則三種溶液的物質的量濃度之比為
A. 1:1:1 B. 1:2:3 C. 1:4:9 D. 6:3:2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在2L密閉容器中進行反應:mX(g)+nY(g)![]() pZ(g)+qQ(g),式中m、n、p、q為化學計量數。在0~3min內,各物質物質的量的變化如下表所示:
pZ(g)+qQ(g),式中m、n、p、q為化學計量數。在0~3min內,各物質物質的量的變化如下表所示:
物質 | X | Y | Z | Q |
起始/mol | 0.7 | 1 | ||
2min末/mol | 0.8 | 2.7 | 0.8 | 2.7 |
3min末/mol | 0.8 |
已知:2min內,ν(Q)=0.075mol·L-1·min-1,ν(Z)∶ν(Y)=1∶2。
(1)方程式中m=______,n=______,p=______,q=______。
(2)2.5min內,Q的轉化率為______________。
(3)對于該反應,能增大正反應速率的措施是___________
A.增大容器體積 B.移走部分Q C.通入大量X D.升高溫度
(4)該反應達到化學平衡狀態時___________
A.容器內氣體壓強保持不變 B.容器內氣體密度保持不變
C.容器內氣體平均摩爾質量保持不變 D.正反應速率與逆反應速率相等
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某學習小組按如下實驗流程探究海帶中碘的制取。
步驟(一)

步驟(二)

已知:①3I2+6NaOH=5NaI+NaIO3+3H2O;②常溫下,碘單質微溶于水,易溶于CCl4。
請回答:
(1)步驟(一)中的儀器名稱:儀器A______________, 儀器 B_______________。
(2)①分液漏斗使用前須檢漏,檢漏方法為__________________________。
②步驟X中,萃取后分液漏斗內觀察到的現象是_______________________。
③下列有關步驟Y的說法,正確的是_______________。
A.應控制NaOH溶液的濃度和體積 B.將碘轉化成離子進入水層
C.主要是除去海帶浸取原液中的有機雜質 D.NaOH溶液可以由乙醇代替
④步驟(二)中操作Z的名稱是_____________。
(3)方案甲中采用蒸餾不合理,理由是_____________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】天然維生素P(結構如圖,圖中R為烷基)存在于槐樹花蕾中,它是一種營養增補劑,關于維生素P的敘述錯誤的是

A. 可與溴水反應,且1 mol該物質與足量溴水反應消耗6 mol Br2
B. 能與NaOH溶液反應,不能與NaHCO3溶液反應
C. 一定條件下1 mol該物質與H2加成消耗H2最大量為7 mol
D. 維生素P遇FeCl3溶液發生顯色反應
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com