
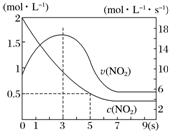
 某絕熱恒容容器中充入2mol•L-1 NO2,發生反應2NO2(g)═N2O4(g)△H=-56.9kJ•mol-1.下列分析不正確的是( )
某絕熱恒容容器中充入2mol•L-1 NO2,發生反應2NO2(g)═N2O4(g)△H=-56.9kJ•mol-1.下列分析不正確的是( )| A. | 5s時NO2的轉化率為75% | |
| B. | 0~3 s時v(NO2)增大是由于體系溫度升高 | |
| C. | 3s時化學反應處于平衡狀態 | |
| D. | 9s時再充入N2O4,平衡后K較第一次平衡時大 |
分析 A、分析圖象5s二氧化氮變化濃度=2mol/L-0.5mol/L=1.5mol/L,結合轉化率概念計算=$\frac{消耗量}{起始量}$×100%;
B、依據反應是放熱反應,在絕熱恒容容器中,反應進行熱量升高,反應速率增大;
C、3s時二氧化氮反應速率最大,但隨時間變化,速率減小,在7s后二氧化氮濃度不變是平衡狀態,此時不能說明反應達到平衡狀態;
D、9s時反應達到平衡狀態,加入N2O4,平衡逆向進行,反應熱量降低,平衡向放熱分析進行,平衡常數增大
解答 解:A、分析圖象5s二氧化氮變化濃度=2mol/L-0.5mol/L=1.5mol/L,結合轉化率概念計算=$\frac{消耗量}{起始量}$×100%=$\frac{1.5molL}{2mol/L}$×100%=75%,故A正確;
B、依據反應是放熱反應,在絕熱恒容容器中,反應進行熱量升高,反應速率增大,隨反應進行二氧化氮濃度減小,反應為達到平衡,0-3s時v(NO2)增大是由于體系溫度升高,故B正確;
C、3s時二氧化氮反應速率最大,但隨時間變化,速率減小,在7s后二氧化氮濃度不變是平衡狀態,3s此時不處于平衡狀態,故C錯誤;
D、9s時反應達到平衡狀態,加入N2O4,平衡逆向進行,反應熱量降低,平衡向放熱分析進行,平衡常數增大,9s時再充入N2O4,平衡后K較第一次平衡時大,故D正確;
故選C.
點評 本題考查化學平衡的計算,題目難度中等,涉及圖象分析判斷,反應速率、轉化率概念計算分析、平衡狀態判斷等知識,明確化學平衡及其影響為解答關鍵,試題培養了學生的化學計算能力.


 沖刺100分單元優化練考卷系列答案
沖刺100分單元優化練考卷系列答案科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 25℃時,0.1 mol/LHX溶液中pH=1 | |
| B. | Ksp(CaX2)隨溫度和濃度的變化而變化 | |
| C. | 該體系中,c(Cl-)=c(Ca2+) | |
| D. | 該體系中HX與CaCl2反應產生沉淀 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
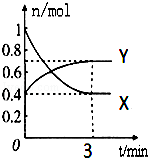 在一定溫度下,體積為2L的密閉容器中,NO2和N2O4之間發生反應:2NO2(g)(紅棕色)?N2O4g)(無色),如圖所示.
在一定溫度下,體積為2L的密閉容器中,NO2和N2O4之間發生反應:2NO2(g)(紅棕色)?N2O4g)(無色),如圖所示.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
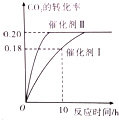 已知CO2可生成綠色燃料甲醇.CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0 300℃時密閉容器中,當c(CO2)=1.00mol/L、c(H2)=1.60mol/L開始反應,結果如圖所示,回答下列問題:
已知CO2可生成綠色燃料甲醇.CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0 300℃時密閉容器中,當c(CO2)=1.00mol/L、c(H2)=1.60mol/L開始反應,結果如圖所示,回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
| 25℃時 | pH值 |
| 飽和H2S溶液 | 3.9 |
| SnS沉淀完全 | 1.6 |
| FeS開始沉淀 | 3.0 |
| FeS沉淀完全 | 5.5 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Na+、K+、CO32-、NO3- | B. | Mg2+、NH4+、SO42-、Cl- | ||
| C. | Fe3+、K+、NO3-、Cl- | D. | Ba2+、HCO3-、NO3-、K+ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com