
鉻化學豐富多彩,由于鉻光澤度好,常將鉻鍍在其他金屬表面,同鐵、鎳組成各種性能的不銹鋼.K2Cr2O7和CrO3大量用于鞣革、印染、顏料、電鍍等工業中,是工業上造成鉻污染的主要原因.近期暴光的“毒膠囊”事件中,就是因為用工業皮革的下腳料或破皮鞋等為原料制成的工業明膠被冒充成食用明膠制成膠囊,造成膠囊內的鉻嚴重超標.

(1)CrO3的熱穩定性較差,加熱時逐步分解,其固體殘留率隨溫度的變化如圖所示.
①A點時剩余固體的成分是________(填化學式).
②從開始加熱到750 K時總反應方程式為________.
(2)Cr(Ⅵ)主要以CrO42-和Cr2O72-形態存在,在酸性條件下具有很強的氧化性,它們在溶液中存在如下轉化:
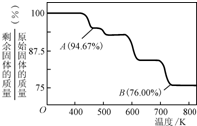
CrO42-(黃色)+2H+![]() Cr2O72-(橙色)+H2O;K=4.2×1014.若要使溶液由黃色變橙色,則應采取的措施是________.
Cr2O72-(橙色)+H2O;K=4.2×1014.若要使溶液由黃色變橙色,則應采取的措施是________.
A.加NaOH
B.加鹽酸
C.加硫酸
D.加AgNO3
(3)工業廢水中常含有一定量的Cr(Ⅵ),毒性較大,它們會對人類及生態系統產生很大損害.凈化處理方法之一是將含Cr2O72-的廢水放入電解槽內,用鐵作陽極,加入適量的NaCl進行電解:陽極區生成的Fe2+和Cr2O72-發生反應,生成的Fe3+和Cr3+在陰極區與OH-結合生成Fe(OH)3和Cr(OH)3沉淀以除去[已KspFe(OH)3=4.0×10-38,KspCr(OH)3=6.0×10-31].
①電解過程中NaCl的作用是________.
②寫出陽極的電極反應式.
③寫出Fe2+和Cr2O72-發生反應生成Fe3+和Cr3+的離子反應方程式________.
④已知電解后的溶液中c(Fe3+)=2.0×10-13 mol·L-1,則溶液中c(Cr3+)為________mol·L-1.
 單元期中期末卷系列答案
單元期中期末卷系列答案科目:高中化學 來源: 題型:閱讀理解
查看答案和解析>>
科目:高中化學 來源: 題型:
 含鉻化合物有毒,對人畜危害很大.因此含鉻廢水必須進行處理才能排放.
含鉻化合物有毒,對人畜危害很大.因此含鉻廢水必須進行處理才能排放.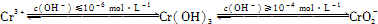
2- 7 |
2- 7 |
查看答案和解析>>
科目:高中化學 來源: 題型:
 鉻化學豐富多彩,由于鉻光澤度好,常將鉻鍍在其他金屬表面,同鐵、鎳組成各種性能的不銹鋼,CrO3大量地用于電鍍工業中.
鉻化學豐富多彩,由于鉻光澤度好,常將鉻鍍在其他金屬表面,同鐵、鎳組成各種性能的不銹鋼,CrO3大量地用于電鍍工業中.查看答案和解析>>
科目:高中化學 來源:2011-2012學年江蘇省高三下學期質量檢測(三)化學試卷(解析版) 題型:填空題
(11分)鉻化學豐富多彩,由于鉻光澤度好,常將鉻鍍在其他金屬表面,同鐵、鎳組成各種性能的不銹鋼,CrO3大量地用于電鍍工業中。
(1)CrO3具有強氧化性,遇到有機物(如酒精)時,猛烈反應以至著火,若該過程中乙醇被氧化成乙酸,CrO3被還原成綠色的硫酸鉻[Cr2(SO4)3]。則該反應的化學方程式為:
____________ 。
(2)CrO3的熱穩定性較差,加熱時逐步分解,其固體殘留率隨溫度的變化如下圖所示。
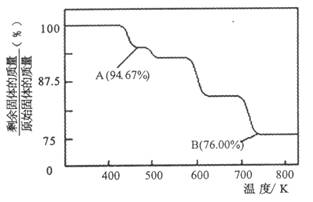
①A 點時剩余固體的成分是_________ (填化學式)。
②從開始加熱到 750K 時總反應方程式為______________________ _。
(3)CrO3和 K2Cr2O7均易溶于水,這是工業上造成鉻污染的主要原因。凈化處理方法之一是將含+6價 Cr 的廢水放入電解槽內,用鐵作陽極,加入適量的NaCl進行電解:陽極區生成的Fe2+和Cr2O72-發生反應,生成的Fe3+和Cr3+在陰極區與OH-結合生成 Fe(OH)3 和Cr(OH)3沉淀除去[已知 KspFe(OH)3=4.0×10-38,KspCr(OH)3=6.0×10-31]。
①電解過程中 NaCl 的作用是__________________________。
②已知電解后的溶液中c(Fe3+)為2.0×10-13 mol·L-1,則溶液中c(Cr3+)為 mol·L-1。
查看答案和解析>>
科目:高中化學 來源:2011-2012學年浙江省高三下學期第一次統練化學試卷 題型:填空題
(16分).鉻化學豐富多彩,由于鉻光澤度好,常將鉻鍍在其他金屬表面,同鐵、鎳組成各種性能的不銹鋼,CrO3大量地用于電鍍工業中。
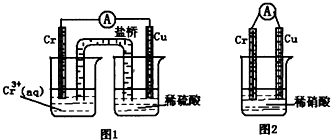
(1)在下圖裝置中,觀察到圖1裝置銅電極上產生大量的無色氣泡,而圖 2裝置中銅電極上無氣體產生,鉻電極上產生大量有色氣體。由圖 1 知金屬鉻的活動性比銅_____(填強,弱),圖 2裝置中鉻電極的電極反應式

(2)CrO3具有強氧化性,遇到有機物(如酒精)時,猛烈反應以至著火,若該過程中乙醇被氧化成乙酸, CrO3被還原成綠色的硫酸鉻[Cr2(SO4)3]。則該反應的化學方程式為_____________________________________________________________。
(3)存在平衡:2CrO42—(黃色)+2H+ Cr2O72—(橙色)+H2O
Cr2O72—(橙色)+H2O
①若平衡體系的pH=2,則溶液顯 色.
②能說明第①步反應達平衡狀態的是 。
a.Cr2O72—和CrO42—的濃度相同 b.2v (Cr2O72—) =v (CrO42—) c.溶液的顏色不變
(4)CrO3和 K2Cr2O7均易溶于水,這是工業上造成鉻污染的主要原因。凈化處理方法之一是將含+6價 Cr 的廢水放入電解槽內,用鐵作陽極,加入適量的NaCl進行電解:陽極區生成的Fe2+和Cr2O72-發生反應,生成的Fe3+和Cr3+在陰極區與OH-結合生成 Fe(OH)3 和Cr(OH)3沉淀除去[已知 KspFe(OH)3=4.0×10-38,KspCr(OH)3=6.0×10-31]。
①電解過程中 NaCl 的作用是__________________________。
②已知電解后的溶液中c(Fe3+)為2.0×10-13 mol·L1,則溶液中c(Cr3+)為____ mol·L-1。
(5)CrO3的熱穩定性較差,加熱時逐步分解,其固體殘留率隨溫度的變化如下圖所示。

從開始加熱到 750K 時總反應方程式為_______________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com