
 鉻化學豐富多彩,由于鉻光澤度好,常將鉻鍍在其他金屬表面,同鐵、鎳組成各種性能的不銹鋼,CrO3大量地用于電鍍工業中.
鉻化學豐富多彩,由于鉻光澤度好,常將鉻鍍在其他金屬表面,同鐵、鎳組成各種性能的不銹鋼,CrO3大量地用于電鍍工業中.| 52 |
| 52+16×3 |
| 52 |
| 52 |
| 42.67 |
| 16 |
| 52 |
| 52 |
| 24 |
| 16 |
| ||
| ||
| 3 |
| ||
| 3 |
| ||
| 3 | 2.0×10-25 |
| KspCr(OH)3 |
| C3(OH-) |
| 6.0×10-31 |
| 2.0×10 -25 |


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:閱讀理解
查看答案和解析>>
科目:高中化學 來源: 題型:
 含鉻化合物有毒,對人畜危害很大.因此含鉻廢水必須進行處理才能排放.
含鉻化合物有毒,對人畜危害很大.因此含鉻廢水必須進行處理才能排放.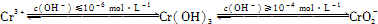
2- 7 |
2- 7 |
查看答案和解析>>
科目:高中化學 來源:2011-2012學年江蘇省高三下學期質量檢測(三)化學試卷(解析版) 題型:填空題
(11分)鉻化學豐富多彩,由于鉻光澤度好,常將鉻鍍在其他金屬表面,同鐵、鎳組成各種性能的不銹鋼,CrO3大量地用于電鍍工業中。
(1)CrO3具有強氧化性,遇到有機物(如酒精)時,猛烈反應以至著火,若該過程中乙醇被氧化成乙酸,CrO3被還原成綠色的硫酸鉻[Cr2(SO4)3]。則該反應的化學方程式為:
____________ 。
(2)CrO3的熱穩定性較差,加熱時逐步分解,其固體殘留率隨溫度的變化如下圖所示。
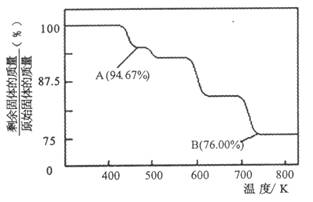
①A 點時剩余固體的成分是_________ (填化學式)。
②從開始加熱到 750K 時總反應方程式為______________________ _。
(3)CrO3和 K2Cr2O7均易溶于水,這是工業上造成鉻污染的主要原因。凈化處理方法之一是將含+6價 Cr 的廢水放入電解槽內,用鐵作陽極,加入適量的NaCl進行電解:陽極區生成的Fe2+和Cr2O72-發生反應,生成的Fe3+和Cr3+在陰極區與OH-結合生成 Fe(OH)3 和Cr(OH)3沉淀除去[已知 KspFe(OH)3=4.0×10-38,KspCr(OH)3=6.0×10-31]。
①電解過程中 NaCl 的作用是__________________________。
②已知電解后的溶液中c(Fe3+)為2.0×10-13 mol·L-1,則溶液中c(Cr3+)為 mol·L-1。
查看答案和解析>>
科目:高中化學 來源:2011-2012學年浙江省高三下學期第一次統練化學試卷 題型:填空題
(16分).鉻化學豐富多彩,由于鉻光澤度好,常將鉻鍍在其他金屬表面,同鐵、鎳組成各種性能的不銹鋼,CrO3大量地用于電鍍工業中。
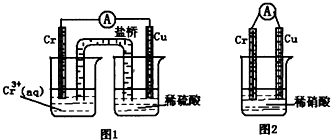
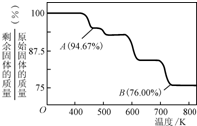
(1)在下圖裝置中,觀察到圖1裝置銅電極上產生大量的無色氣泡,而圖 2裝置中銅電極上無氣體產生,鉻電極上產生大量有色氣體。由圖 1 知金屬鉻的活動性比銅_____(填強,弱),圖 2裝置中鉻電極的電極反應式

(2)CrO3具有強氧化性,遇到有機物(如酒精)時,猛烈反應以至著火,若該過程中乙醇被氧化成乙酸, CrO3被還原成綠色的硫酸鉻[Cr2(SO4)3]。則該反應的化學方程式為_____________________________________________________________。
(3)存在平衡:2CrO42—(黃色)+2H+ Cr2O72—(橙色)+H2O
Cr2O72—(橙色)+H2O
①若平衡體系的pH=2,則溶液顯 色.
②能說明第①步反應達平衡狀態的是 。
a.Cr2O72—和CrO42—的濃度相同 b.2v (Cr2O72—) =v (CrO42—) c.溶液的顏色不變
(4)CrO3和 K2Cr2O7均易溶于水,這是工業上造成鉻污染的主要原因。凈化處理方法之一是將含+6價 Cr 的廢水放入電解槽內,用鐵作陽極,加入適量的NaCl進行電解:陽極區生成的Fe2+和Cr2O72-發生反應,生成的Fe3+和Cr3+在陰極區與OH-結合生成 Fe(OH)3 和Cr(OH)3沉淀除去[已知 KspFe(OH)3=4.0×10-38,KspCr(OH)3=6.0×10-31]。
①電解過程中 NaCl 的作用是__________________________。
②已知電解后的溶液中c(Fe3+)為2.0×10-13 mol·L1,則溶液中c(Cr3+)為____ mol·L-1。
(5)CrO3的熱穩定性較差,加熱時逐步分解,其固體殘留率隨溫度的變化如下圖所示。

從開始加熱到 750K 時總反應方程式為_______________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com