

分析 含Cr2O72-離子的廢水加入Na2S2O3溶液調節溶液pH=2-3,重鉻酸根離子被還原為Cr3+離子,再加入氫氧化鈉溶液控制溶液pH生成Cr(OH)3;
(1)可以代替上述流程中Na2S2O3溶液,需要具有還原性,能還原重鉻酸根離子;
(2)每消耗0.1mol Na2S2O3轉移0.8mol e-,根據電子轉移守恒,可知S2O32-被氧化生成SO42-,而Cr2O72-離子被還原為Cr3+離子,配平書寫離子方程式;
(3)Cr(OH)3的化學性質與Al(OH)3相似,顯示兩性,可以溶解在強酸、強堿溶液中,反應生成NaCrO2與H2O.
解答 解:含Cr2O72-離子的廢水加入Na2S2O3溶液調節溶液pH=2-3,重鉻酸根離子被還原為Cr3+離子,再加入氫氧化鈉溶液控制溶液pH生成Cr(OH)3.
(1)可以代替上述流程中Na2S2O3溶液,需要具有還原性,能還原重鉻酸根離子,
A.FeSO4溶液中亞鐵離子具有還原性,可以還原Cr2O72-離子,故A符合;
B.濃H2SO4 具有強氧化性,不能表現還原性,不能還原Cr2O72-,故B不符合;
C.酸性KMnO4 是強氧化劑不能還原Cr2O72-,故C不符合;
D.Na2SO3溶液中亞硫酸根離子具有還原性,可以還原Cr2O72-,故D符合;
故答案為:AD;
(2)每消耗0.1mol Na2S2O3轉移0.8mol e-,根據電子轉移守恒,可知S2O32-被氧化生成SO42-,而Cr2O72-離子被還原為Cr3+離子,配平可得離子方程式為:3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O;
故答案為:3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O;
(3)Cr(OH)3的化學性質與Al(OH)3相似,Cr(OH)3可以溶解在過量的氫氧化鈉溶液中,反應生成NaCrO2與H2O,反應離子方程式為:Cr(OH)3+OH-=CrO2-+2H2O,在上述生產過程中加入NaOH溶液時要控制溶液的pH不能過高,防止Cr(OH)3溶解,
故答案為:Cr(OH)3+OH-=CrO2-+2H2O.
點評 本題考查物質分離提純的綜合應用,涉及對試劑及控制條件的分析評價、氧化還原反應的理解應用,題目難度中等.


科目:高中化學 來源: 題型:解答題
 海洋是一個巨大的聚寶盆,含有豐富的礦產資源和水資源,若把海水淡化和化工生產結合起來,既可解決淡水資源缺乏的問題,又可充分利用海洋資源.
海洋是一個巨大的聚寶盆,含有豐富的礦產資源和水資源,若把海水淡化和化工生產結合起來,既可解決淡水資源缺乏的問題,又可充分利用海洋資源.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 酸式滴定管只用水洗 | |
| B. | 錐形瓶只用水洗 | |
| C. | 使用甲基橙做指示劑 | |
| D. | 第一次觀察酸式滴定管的刻度時仰視 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| 氫氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 開始沉淀pH | 1.5 | 3.3 | 9.4 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
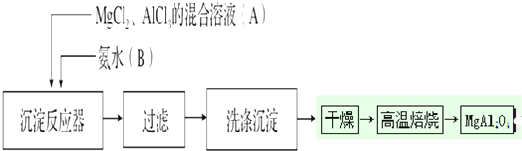
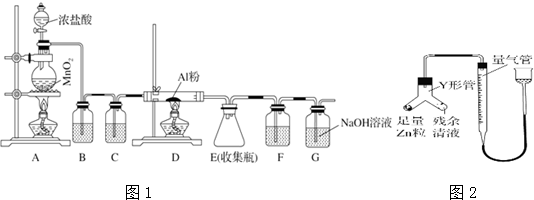
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 實驗室中有一未知濃度的稀鹽酸,某學生為測定鹽酸的濃度在實驗室中進行如下實驗:請完成下列填空:
實驗室中有一未知濃度的稀鹽酸,某學生為測定鹽酸的濃度在實驗室中進行如下實驗:請完成下列填空:| 實驗編號 | NaOH溶液的濃度 (mol/L) | 滴定完成時,NaOH溶液滴入的體積(mL) | 待測鹽酸溶液的體積 (mL) |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氫氣通過灼熱的CuO粉末 | B. | 碳與SiO2高溫反應制粗硅 | ||
| C. | 將鋅粒投入Cu(NO3)2溶液 | D. | 鎂條在CO2中燃燒 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com