
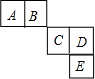
 前四周期主族元素A、B、C、D、E在元素周期表中的相對位置如圖所示,其中C元素原子的最外層電子數與最內層電子敦之和等于其電子總數的一半,下列說法正確的是( )
前四周期主族元素A、B、C、D、E在元素周期表中的相對位置如圖所示,其中C元素原子的最外層電子數與最內層電子敦之和等于其電子總數的一半,下列說法正確的是( )| A. | 元素A、B的所有氫化物中均只含有極性共價鍵 | |
| B. | 元素C、D形成的簡單離子的電子總數不同 | |
| C. | 元素C、D、E形成的常見單質的熔沸點大小:E>D>C | |
| D. | C、D、E三種元素最高價氧化物對應的水化物中D的酸性最強 |
分析 前四周期主族元素A、B、C、D、E在元素周期表中的相對位置如圖所示,則E位于第四周期、CD處于第三周期,C元素原子的最外層電子數與最內層電子數之和等于其電子總數的一半,設C的最外層電子式為x,則x+2=$\frac{1}{2}$(2+8+x),解得x=6,則C為S元素、D為Cl元素、E為Br元素、A為C元素、B為N元素,據此進行解答.
解答 解:前四周期主族元素A、B、C、D、E在元素周期表中的相對位置如圖所示,則E位于第四周期、CD處于第三周期,C元素原子的最外層電子數與最內層電子數之和等于其電子總數的一半,設C的最外層電子式為x,則x+2=$\frac{1}{2}$(2+8+x),解得x=6,則C為S元素、D為Cl元素、E為Br元素、A為C元素、B為N元素,
A.A為C元素、B為N元素,烴類屬于C的氫化物,多個C原子的烴類物質中含有C-C非極性鍵,故A錯誤;
B.C為S元素、D為Cl元素,二兒子的簡單離子為硫離子和氯離子,二者都含有18個電子,故B錯誤;
C.C為S元素、D為Cl元素、E為Br元素,對應單質為硫單質、氯氣和溴,常溫下硫單質為固態、氯氣為氣態、溴為液態,則熔沸點大小為:S>Br2>Cl2,即:C>E>D,故C錯誤;
D.C為S元素、D為Cl元素、E為Br元素,非金屬性最強的為Cl元素,則三種元素最高價氧化物對應的水化物中D的酸性最強,故D正確;
故選D.
點評 本題考查了原子結構與元素周期律的關系,題目難度中等,正確推斷C元素為解答關鍵,注意熟練掌握原子結構與元素周期律、元素周期表的關系,試題培養了學生的分析能力及靈活應用能力.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| Cl2的體積(標準狀況) | 2.8L | 5.6L | 11.2L |
| n(Cl-) | 1.25mol | 1.5mol | 2mol |
| n(Br-) | 1.5mol | 1.4mol | 0.9mol |
| n(I-) | amol | 0 | 0 |
| A. | 當通入Cl2的體積為2.8L時,只有I-與Cl2發生反應 | |
| B. | 當通入Cl2的體積為2.8-5.6L時,只有Br-與Cl2發生反應 | |
| C. | a=0.15 | |
| D. | 原溶液中c(Cl-):c(Br-):c(I-)=10:15:4 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 5.6g Fe粉與足量的稀硝酸完全反應,失電子總數為0.2NA | |
| B. | 2NA個二氧化碳分子的質量為44g | |
| C. | 1000mL0.1mol/L的NaCl溶液中,Na+與Cl-離子總數為0.2NA | |
| D. | 17g氨氣中所含原子數為NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 中性、漂白性 | B. | 酸性、漂白性 | C. | 只有酸性 | D. | 只有漂白性 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 堿金屬單質的熔點隨原子序數的增大而降低 | |
| B. | Cs是第ⅠA族元素,Cs失電子能力比Na的強 | |
| C. | 砹(At)是第VIIA族,其氫化物的穩定性大于HCl | |
| D. | 第三周期金屬元素的最高價氧化物對應水化物,其堿性隨原子序數的增大而減弱 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NaOH | B. | NH3•H2O | C. | ZnO | D. | ZnCl2 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com