
分析 (1)反應方程式為:N2H4+2H2O2=N2+4H2O,根據0.4mol液態肼放出的熱量,計算1mol液態肼放出的熱量,進而寫出熱化學方程式;
(2)根據蓋斯定律合并寫出生成液態水時的熱化學方程式進行計算;
(3)依據反應N2H4(g)+2H2O2(l)=N2(g)+4H2O(g)的產物是氮氣和水分析該反應的優點;
(4)甲醇燃料電池放電時,C元素的化合價升高,所以甲醇所在電極為原電池的負極,O元素的化合價降低,所以通入氧氣的極為原電池的正極,負極上發生氧化反應,正極上發生還原反應,以此來解答.
解答 解:(1)反應方程式為:N2H4+2H2O2═N2+4H2O,0.4mol液態肼放出256.652KJ的熱量,則1mol液態肼放出的熱量為$\frac{265.652kJ}{0.4}$=641.63kJ,
所以反應的熱化學方程式為:N2H4(g)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.63kJ/mol,
故答案為:N2H4(g)+2H2O2(l)=N2(g)+4H2O(g)△H=-641.63kJ/mol;
(2)①N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.63kJ/mol;
②H2O(g)=H2O(l)△H=-44kJ/mol;
依據蓋斯定律①+②×4得到:N2H4(l)+2H2O2(l)═N2(g)+4H2O(l);△H=-817.63kJ/mol;
熱化學方程式中32g全部反應放熱817.63kJ,16g液態肼與足量雙氧水反應生成氮氣和液態水時,放出的熱量為:817.63kJ×$\frac{1}{2}$=408.815kJ,
故答案為:408.815;
(3)還原劑肼(N2H4)和強氧化劑H2O2,當它們混合時,即產生大量的氮氣和水蒸氣,除釋放大量熱量和快速產生大量氣體外,還有很突出的優點是,產物為氮氣和水,清潔無污染,
故答案為:產物無污染;
(4)CH3OH和O2在電池中,肯定是O2氧化CH3OH,CH3OH是負極反應物,O2是正極反應物.CH3OH被氧化生成CO2和H2O,電解質溶液中有強堿(OH-),CO2要轉化CO32-.
①甲醇是負極,電極反應式為:CH3OH+8OH--6e-═CO32-+6H2O,故答案為:負;CH3OH+8OH--6e-═CO32-+6H2O;
②CH3OH被氧化生成CO2和H2O,電解質溶液中有強堿(OH-),則CO2要轉化CO32-,電池反應為:2CH3OH+3O2+4OH-═2CO32-+6H2O,
故答案為:2CH3OH+3O2+4OH-═2CO32-+6H2O.
點評 本題考查了熱化學方程式的書寫、有關反應熱的計算,題目難度中等,注意蓋斯定律的應用,試題培養了學生的分析、理解能力及靈活應用所學知識的能力.


 每日10分鐘口算心算速算天天練系列答案
每日10分鐘口算心算速算天天練系列答案科目:高中化學 來源: 題型:選擇題
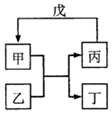 甲、乙、丙、丁、戊的相互轉化關系如圖所示(反應條件略去,箭頭表示一步轉化).下列各物質中,不滿足如圖轉化關系的是( )
甲、乙、丙、丁、戊的相互轉化關系如圖所示(反應條件略去,箭頭表示一步轉化).下列各物質中,不滿足如圖轉化關系的是( ) | 甲 | 乙 | 丙 | 戊 | |
| ① | SiO2 | NaOH | Na2SiO3 | CO2 |
| ② | Fe | H2O | Fe2O3 | H2 |
| ③ | Al(OH)3 | NaOH溶液 | NaAlO2溶液 | 過量CO2 |
| ④ | Na2O2 | CO2 | O2 | Na |
| A. | ①③ | B. | ①② | C. | ②④ | D. | ①④ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
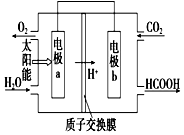 燃料的使用和防污染是社會發展中一個無法回避的矛盾話題.
燃料的使用和防污染是社會發展中一個無法回避的矛盾話題.查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
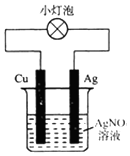
| A. | 該裝置外電路中電流由Cu棒轉移到Ag棒 | |
| B. | 該裝置中正極是Cu、負極是Ag | |
| C. | 該裝置可以將電能轉化為化學能 | |
| D. | 該裝置中正極上的電極反應為Ag++e-=Ag |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 實驗剩余的藥品不能放回原試劑瓶 | |
| B. | 滴管不能交叉使用 | |
| C. | 氣體實驗裝置在實驗前進行氣密性檢查 | |
| D. | 可燃性氣體的驗純 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com