
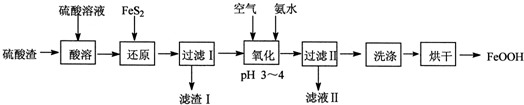
分析 硫酸渣(主要含Fe2O3、FeO,雜質為Al2O3和SiO2等)加硫酸溶解,金屬氧化物轉化為金屬陽離子,二氧化硅不溶,再加FeS2把鐵離子還原為Fe2+,同時生成S沉淀,過濾,濾渣含有二氧化硅和S、FeS2,濾液中含有Fe2+和Al3+,濾液中通入空氣氧化,同時調節pH生成FeOOH沉淀,過濾、洗滌、烘干,得到純凈的FeOOH;
(1)氧化鐵是堿性氧化物,可以和酸反應生成鹽和水;
(2)根據流程分析判斷;由反應物和生成物以及電子守恒來配平化學方程式;
(3)在堿性環境下,亞鐵離子可以被氧氣氧化為生成FeOOH;
(4)加氨水調節pH時,生成了硫酸銨;鐵黃表面附著的離子為硫酸根離子,若洗液中沒有硫酸根離子,說明已經洗凈,根據檢驗硫酸根離子的方法分析.
解答 解:硫酸渣(主要含Fe2O3、FeO,雜質為Al2O3和SiO2等)加硫酸溶解,金屬氧化物轉化為金屬陽離子,二氧化硅不溶,再加FeS2把鐵離子還原為Fe2+,同時生成S沉淀,過濾,濾渣含有二氧化硅和S、FeS2,濾液中含有Fe2+和Al3+,濾液中通入空氣氧化,同時調節pH生成FeOOH沉淀,過濾、洗滌、烘干,得到純凈的FeOOH;
(1)氧化鐵是堿性氧化物,可以和硫酸反應生成硫酸鐵和水,即Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,
故答案為:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;
(2)由流程分析可知濾渣Ⅰ的主要成分是FeS2、S和SiO2;-2價的硫離子具有還原性,FeS2可以將溶液中的Fe3+還原為Fe2+,而本身被氧化為S沉淀,有關的離子方程式為2Fe3++FeS2=3Fe2++2S,
故答案為:SiO2;2Fe3++FeS2=3Fe2++2S;
(3)在堿性環境下,亞鐵離子可以被氧氣氧化為生成FeOOH,則“氧化”中,亞鐵離子、氧氣及氨水反應生成FeOOH、銨根離子和水,其離子方程式為4Fe2++8NH3•H2O+O2=4FeOOH↓+8NH4++2H2O,
故答案為:4Fe2++8NH3•H2O+O2=4FeOOH↓+8NH4++2H2O;
(4)濾液I中加氨水調節pH,會生成硫酸銨,所以濾液Ⅱ中溶質是Al2(SO4)3和 (NH4)2SO4;
鐵黃表面附著的離子為硫酸根離子,若洗液中沒有硫酸根離子,說明已經洗凈,則其操作為取最后一次洗滌液,滴加鹽酸酸化的BaCl2溶液,若無白色沉淀說明已洗干凈.
故答案為:(NH4)2SO4;取最后一次洗滌液,滴加鹽酸酸化的BaCl2溶液,若無白色沉淀說明已洗干凈.
點評 本題以鐵黃(FeOOH)的制備流程為知識背景,考查硅、鐵的化合物的性質、離子方程式的書寫、物質的分離提純等,難度中等,清楚工藝流程原理是解題的關鍵,是對知識遷移的綜合運用.


科目:高中化學 來源: 題型:選擇題
 新型NaBH4-H2O2燃料電池(DBFC)的結構如圖所示(已知NaBH4中氫為-1價),有關該電池的說法不正確的是( )
新型NaBH4-H2O2燃料電池(DBFC)的結構如圖所示(已知NaBH4中氫為-1價),有關該電池的說法不正確的是( )| A. | 放電過程中Na+從A極區向B極區遷移 | |
| B. | 電極B材料中含MnO2層,MnO2起導電作用 | |
| C. | 在電池反應中,每消耗1 L 6 mol•L-1H2O2溶液,理論上流過電路中的電子為12 個NA | |
| D. | 電池負極區的電極反應為BH4-+8OH--8e-=BO2+6H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1.68g鐵粉發生吸氧腐蝕時,理論上最多能吸收氧氣504mL(標準狀況) | |
| B. | 鍍層破損后,白鐵(鍍鋅的鐵)比馬口鐵(鍍錫的鐵)更易被腐蝕 | |
| C. | 為保護海輪的船殼,常在船殼外面鑲上鋅塊 | |
| D. | 化學電源的能量來源于氧化還原反應所釋放的化學能 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 的下列說法中正確的是( )
的下列說法中正確的是( )| A. | 分子式為C9H9O2 | |
| B. | 含有三種官能團 | |
| C. | 可使溴的四氯化碳溶液或酸性KMnO4溶液褪色 | |
| D. | 可以發生取代反應和加成反應,但不能發生聚合反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 向盛有少量Mg(OH)2沉淀的試管中滴加適量NH4Cl溶液,沉淀溶解:Mg(OH)2+2NH4+=2NH3•H2O+Mg2+ | |
| B. | SO2通入澄清石灰水中,產生白色沉淀:SO2+Ca2++2OH-=CaSO4↓+H2O | |
| C. | 向Ca(HCO3)2溶液中加入過量NaOH溶液,有白色沉淀生成:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O | |
| D. | 長期過量服用阿司匹林出現水楊酸(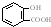 )反應,可靜脈注滴NaHCO3溶液: )反應,可靜脈注滴NaHCO3溶液: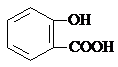 +HCO3-→ +HCO3-→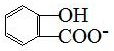 +CO2↑+H2O +CO2↑+H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鹵素單質Cl2、Br2、I2的氧化性 | |
| B. | 氣態氫化物NH3、H2O、HF的穩定性 | |
| C. | 堿金屬單質Li、Na、K與水反應的劇烈程度 | |
| D. | 1mol Na、Mg、Al分別與足量鹽酸反應時失電子數的多少 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | SO2可用作漂白劑,原因是具有還原性 | |
| B. | FeCl3溶液可用于制印刷電路板,原因是能氧化Cu | |
| C. | Cl2可制漂白粉,原因是能與NaOH反應 | |
| D. | Al(OH)3可用于治療胃酸過多,原因是堿性強 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 平行光照射膠體產生丁達爾現象 | B. | 紫外線照射下,液態蛋白質凝固 | ||
| C. | 電解質溶液導電過程 | D. | 鐵遇到冷的濃硝酸溶液發生鈍化 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com