
| 化學式 | CH3COOH | HClO | H2CO3 |
| Ka | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
| A. | 相同pH的三種酸溶液,物質的量濃度由大到小的順序為:c(HClO)>c(CH3COOH)>c(H2CO3) | |
| B. | 在相同物質的量濃度的Na2CO3、NaClO、NaHCO3與CH3COONa四種鈉鹽中加水稀釋,水解程度均增大,堿性均增強 | |
| C. | 等物質的量濃度的NaClO和NaHCO3 混合溶液中:c(Na+)=c(HClO)+c(ClO-)+c(HCO3-)+c(CO32-)+c(H2CO3) | |
| D. | 向次氯酸鈉溶液中通入少量二氧化碳氣體的離子方程式為:2ClO-+CO2+H2O═CO32-+2HClO |
分析 A.酸的電離常數越大,其酸性越強;
B.水解程度增大,但是溶液中氫氧根離子濃度減小,溶液的堿性均減弱;
C.根據Cl原子與C原子相等,結合溶液中物料守恒分析;
D.次氯酸的酸性大于碳酸氫根離子,根據強酸制取弱酸判斷.
解答 解:A.酸的電離常數越大,其酸性越強,所以等物質的量濃度溶液酸性由強到弱的順序為:CH3COOH>H2CO3>HClO,故A錯誤;
B.稀釋過程中酸根離子的水解程度都增大,但是溶液中氫氧根離子的濃度都減小,則溶液的堿性都減弱,故B錯誤;
C.等物質的量濃度的NaClO和NaHCO3混合溶液中,Cl原子與C原子相等,由溶液中物料守恒可知:c(HClO)+c(ClO-)=c(HCO3-)+c(CO32-)+c(H2CO3)=c(Na+),則:c(Na+)=c(HClO)+c(ClO-)+c(HCO3-)+c(CO32-)+c(H2CO3),故C正確;
D.碳酸的二級電離小于次氯酸,所以碳酸氫根離子的酸性小于次氯酸,則向NaClO溶液中通入少量二氧化碳的離子方程式為:ClO-+CO2+H2O═HClO+HCO3-,故D錯誤;
故選C.
點評 本題考查離子濃度大小比較,題目難度中等,明確酸的電離常數與酸的強弱、酸根離子水解能力的關系是解本題關鍵,注意掌握電荷守恒、物料守恒的含義及應用方法,試題培養了學生的靈活應用能力.


 快捷英語周周練系列答案
快捷英語周周練系列答案科目:高中化學 來源: 題型:選擇題
| A. | H2 為 0.6mol/L、N2 為 0.2mol/L | B. | NH3為 0.25mol/L | ||
| C. | N2、NH3 均為 0.15mol/L | D. | NH3為 0.4mol/L |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
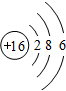 ,
,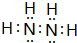
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 乙醇能夠使蛋白質變性,75%(體積分數)的乙醇溶液可用于醫療消毒 | |
| B. | 乙二醇的水溶液凝固點很低,可用作汽車發動機的抗凍劑 | |
| C. | 光照時乙烷與氯氣能發生取代反應,工業上常用該反應生產氯乙烷 | |
| D. | 油脂的堿性水解又稱為皂化,其產物之一高級脂肪酸鹽可用于制造肥皂 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
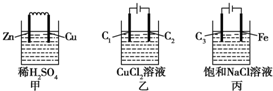
| A. | 甲、丙中是化學能轉變為電能,乙中是電能轉變為化學能 | |
| B. | C1、C2分別是陽極、陰極,鋅片、鐵片上都發生氧化反應 | |
| C. | C1上和C3上放出的氣體相同,銅片上和鐵片上放出的氣體也相同 | |
| D. | 甲、乙、丙中溶液的pH都逐漸升高 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
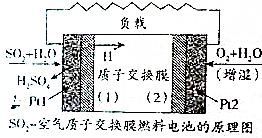 二氧化硫、空氣質子交換膜電池將化學能默認變成電能的同時,實現了制硫酸、發電、環保三位一體的結合,降低了成本提高了效益,其原理如圖所示,下列說法錯誤的是( )
二氧化硫、空氣質子交換膜電池將化學能默認變成電能的同時,實現了制硫酸、發電、環保三位一體的結合,降低了成本提高了效益,其原理如圖所示,下列說法錯誤的是( )| A. | Pt1電極附近發生的反應為SO2+2H2O-2e-═SO42-+4H+ | |
| B. | Pt2電極附近發生的反應為O2+4e-═2O2- | |
| C. | 該電池放電時電子從Pt1電極經過外電路流到Pt2電極 | |
| D. | 相同條件下,放電過程中消耗的SO2和O2的體積之比為2:1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 煤炭、石油、沼氣 | B. | 風能、太陽能、沼氣 | ||
| C. | 地熱能、海洋能、核能 | D. | 生物質能、天然氣、水能 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com