
 X、Y、Z、W、Q是原子序數依次增大的五種短周期主族元素.其中只有Z是金屬,W的單質是黃色固體,X、Y、W在周期表中的相對位置如圖.下列說法正確的是( )
X、Y、Z、W、Q是原子序數依次增大的五種短周期主族元素.其中只有Z是金屬,W的單質是黃色固體,X、Y、W在周期表中的相對位置如圖.下列說法正確的是( )| A. | 五種元素中,原子半徑最大的是W | |
| B. | Y的簡單陰離子比W的簡單陰離子還原性強 | |
| C. | Y與Z形成的化合物都可以和鹽酸反應 | |
| D. | Q形成的含氧酸一定比W形成的含氧酸強 |
分析 均為短周期主族元素,其中W的單質是黃色固體,則W為S,由X、Y、W在周期表中的相對位置可知,Y為O元素,X為C碳元素,X、Y、Z、W、Q是原子序數依次增大,所以Q為Cl,其中只有Z是金屬,則Z可能為Na、Mg、Al中的一種,然后結合元素的單質化合物的性質及元素周期律來解答.
解答 解:均為短周期主族元素,其中W的單質是黃色固體,則W為S,由X、Y、W在周期表中的相對位置可知,Y為O元素,X為C碳元素,X、Y、Z、W、Q是原子序數依次增大,所以Q為Cl,其中只有Z是金屬,則Z可能為Na、Mg、Al中的一種.
A.同周期自左而右原子半徑增大,電子層越多原子半徑越大,故原子半徑:Z>W>Q>X>Y,故A錯誤;
B.同主族自上而下元素非金屬性減弱,非金屬性越強,陰離子還原性越弱,故Y的簡單陰離子比W的簡單陰離子還原性弱,故B錯誤;
C.Y與Z形成的化合物可能為氧化鈉、過氧化鈉、氧化鎂、氧化鋁,均能與鹽酸反應,故C正確;
D.Q形成含氧酸中次氯酸為弱酸,酸性比硫酸弱,故D錯誤,
故選C.
點評 本題考查位置結構性質關系應用,注意把握元素周期表和元素周期律,元素的推斷是解答本題的關鍵,W為淡黃色固體為突破口,注意Z元素的不確定性,難度不大.


 舉一反三同步巧講精練系列答案
舉一反三同步巧講精練系列答案 口算與應用題卡系列答案
口算與應用題卡系列答案 名師點睛字詞句段篇系列答案
名師點睛字詞句段篇系列答案科目:高中化學 來源: 題型:選擇題
| 編號 | ① | ② | ③ | ④ |
| pH | 10 | 10 | 4 | 4 |
| 溶液 | 氨水 | 氫氧化鈉溶液 | 醋酸溶液 | 鹽酸 |
| A. | 相同體積③、④溶液分別與NaOH完全反應,消耗NaOH物質的量:③>④ | |
| B. | 分別加水稀釋10倍,四種溶液的pH①>②>④>③ | |
| C. | ①、④兩溶液等體積混合,所得溶液中c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| D. | Va L ④溶液與Vb L ②溶液混合(近似認為混合溶液體積=Va+Vb),若混合后溶液pH=5,則Va :Vb=11:9 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
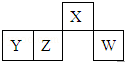 短周期元素X、Y、Z、W在元素周期表中的相對位置如圖所示,其中W原子的最外層電子數是最內層電子數的3倍.下列判斷正確的是( )
短周期元素X、Y、Z、W在元素周期表中的相對位置如圖所示,其中W原子的最外層電子數是最內層電子數的3倍.下列判斷正確的是( )| A. | 原子半徑:W>Z>Y>X | |
| B. | X的氫化物與氯化氫反應的產物溶于水形成的溶液呈酸性 | |
| C. | 最簡單氣態氫化物的熱穩定性:Z>W | |
| D. | 含Y元素的鹽溶液一定顯酸性 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氨氣極易溶于水,所得的氨水中存在3種不同的氫鍵 | |
| B. | [Ag(NH3)2]+ 中含有6個σ鍵 | |
| C. | [Ag(NH3)2]OH所含有的化學鍵有離子鍵、極性共價鍵和配位鍵 | |
| D. | 在[Ag(NH3)2]+離子中Ag+給出孤對電子,NH3提供空軌道 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 原子序數是15 | B. | 它是非金屬元素 | ||
| C. | 磷原子最外層有5個電子 | D. | 磷元素在地殼中的含量為30.97% |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CH3CH2CH3分子中的3個碳原子不可能在同一直線上 | |
| B. | 油脂在酸性條件下的水解反應稱為皂化反應 | |
| C. | 聚氯乙烯、麥芽糖和蛋白質均屬于有機高分子化合物 | |
| D. | CH3CH2OH與CH3CO18OH發生酯化反應所得混合液中,18O原子只存在于水分子中 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 若2分鐘達到化學平衡時N2還剩下0.4mol,則v(N2)=0.3mol/(L•min) | |
| B. | 達到化學平衡時,單位時間內每生成0.1mol的H2同時生成0.1mol的NH3 | |
| C. | 達到化學平衡時,N2、H2和NH3的物質的量濃度不再變化 | |
| D. | 達到化學平衡后,若增大壓強使容器體積縮小,化學反應速率將會增大 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com