
分析 根據氯化鎂的相對分子質量確定其摩爾質量;根據V=nVm計算出標準狀況下0.1mol二氧化碳的體積;根據硝酸銅的化學式計算出硝酸根離子的濃度.
解答 解:MgCl2的相對分子質量為95,則其摩爾質量為95g•mol-1;
標準狀況下0.1mol二氧化碳的體積為:22.4L/mol×0.1mol=2.24L;
0.2mol•L-1的 Cu(NO3)2溶液中NO3-的物質的量濃度是:0.2mol/L×2=0.4mol/L,
故答案為:95g•mol-1;2.24 L;0.4 mol•L-1.
點評 本題考查了物質的量的計算,題目難度不大,明確物質的量與氣體摩爾體積、物質的量濃度之間的關系為解答關鍵,試題側重基礎知識的考查,有利于提高學生的化學計算能力.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:實驗題

查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | △H4=$\frac{2}{3}$ (3△H3-△H1)-△H2 | B. | △H4=$\frac{2}{3}$ (△H1+△H2)+△H3 | ||
| C. | △H4=$\frac{2}{3}$ (△H1+△H2)-△H3 | D. | △H4=$\frac{2}{3}$ (△H1-△H2)-△H3 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| t/s | 0 | 500 | 1000 |
| c(N2O5)/mol•L-1 | 5.00 | 3.50 | 2.50 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
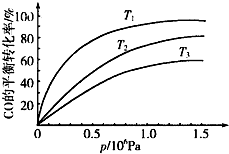 鐵及其化合物在日常生活、生產中應用廣泛,研究鐵及其化合物的應用意義重大.回答下列問題:
鐵及其化合物在日常生活、生產中應用廣泛,研究鐵及其化合物的應用意義重大.回答下列問題:| 溫度 | 250℃ | 600℃ | 1000℃ | 2000℃ |
| 主要成分 | Fe2O3 | Fe3O4 | FeO | Fe |
| t/min | 0 | 10 | 20 | 30 | 40 | 50 |
| x(CO) | 0.25 | 0.23 | 0.214 | 0.202 | 0.193 | 0.193 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 升高溫度,平衡常數K變大 | |
| B. | 增大壓強,W(g)物質的量分數變大 | |
| C. | 升溫,若混合氣體的平均相對分子質量變小,則正反應放熱 | |
| D. | 增大X濃度,平衡向正反應方向移動 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 標準狀況下,22.4L氯氣與足量氫氧化鈉溶艘反應轉移的電子數為2NA | |
| B. | 將含有1molFeCl3的飽和溶液加入到沸水中得到氫氧化鐵膠體,其中膠體粒子的數目為NA | |
| C. | 兩份2.7g鋁分別與100 mL濃度為2mol•L-1的鹽酸和氫氧化鈉溶液充分反應,轉移的電子數均為0.3NA | |
| D. | 通常情況下,16g CH4中含有4NA個C-H鍵 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com