


分析 (1)分析裝置Ⅰ是制備氯氣的發生裝置,生成的氯氣中含有氯化氫和水蒸氣,需要除雜,通過飽和食鹽水除去氯化氫,通過濃硫酸除去水蒸氣,進入裝置Ⅳ和錫反應生成SnCl4、試管Ⅱ中的試劑是飽和食鹽水,
故答案為:飽和食鹽水;
(2)SnCl2、SnCl4均易水解,易溶于有機溶劑,且Sn2+易被氧化,應避免空氣中成分進入裝置Ⅴ;
(3)回收利用裝置I中未反應完的MnO2,二氧化錳難溶于水用過濾操作回收,結合過濾裝置選擇需要的儀器;
(4)甲同學認為V中產品可能含有SnCl2,檢測產品中是否存在SnCl2,可以利用其還原性設計實驗驗證;
(5)過量FeCl3,將Sn2+氧化成Sn4+,本身被還原為亞鐵離子,結合原子守恒和電荷守恒寫出離子方程式;根據n=cV計算反應中消耗的K2Cr2O7的物質的量;根據方程式可得關系式3Sn~3SnCl2~6FeCl3~6FeCl2~K2Cr2O7,據此計算n(Sn),再根據m=nM計算m(Sn),利用質量分數定義計算試樣中Sn的百分含量.
解答 解:(1)分析裝置Ⅰ是制備氯氣的發生裝置,生成的氯氣中含有氯化氫和水蒸氣,需要除雜,通過飽和食鹽水除去氯化氫,通過濃硫酸除去水蒸氣,進入裝置Ⅳ和錫反應生成SnCl4,故答案為:飽和食鹽水;
(2)SnCl2、SnCl4均易水解,易溶于有機溶劑,且Sn2+易被氧化,應避免空氣中成分進入裝置Ⅴ,
A裝置可以吸收剩余氣體,但不能保證水蒸氣進入裝置Ⅴ,B裝置不能吸收剩余氯氣,裝置C可以吸收水蒸氣和二氧化碳,能避免空氣中二氧化碳和水蒸氣進入裝置Ⅴ,故選C,
故答案為:C;
(3)回收利用裝置I中未反應完的MnO2,二氧化錳難溶于水用過濾操作回收,結合過濾裝置選擇需要的儀器為:普通漏斗、玻璃棒、燒杯,
故答案為:普通漏斗、玻璃棒、燒杯;
(4)甲同學認為V中產品可能含有SnCl2,檢測產品中是否存在SnCl2,可以利用其還原性設計實驗驗證,取適量溴的四氯化碳溶液向其中加入足量的產品振蕩,溶液顏色褪去,則證明含有SnCl2,否則不含,
故答案為:取適量溴的四氯化碳溶液向其中加入足量的產品振蕩,溶液顏色褪去;
(5)第二步:過量FeCl3,將Sn2+氧化成Sn4+,本身被還原為亞鐵離子,反應的離子方程式為:2Fe3++Sn2+=2Fe2++Sn4+,反應中消耗的K2Cr2O7的物質的量為1.0mol/L×0.020L=0.02mol,
根據方程式可得關系式3Sn~3SnCl2~6FeCl3~6FeCl2~K2Cr2O7,
故n(Sn)=3n(K2Cr2O7)=3×0.02mol=0.06mol,
Sn的質量為:0.06mol×119g/mol=7.14g,
試樣中Sn的百分含量為$\frac{7.14g}{7.5g}$×100%=95.2%,
故答案為:2Fe3++Sn2+=2Fe2++Sn4+;95.2%.
點評 本題考查實驗探究和物質制備方法和過程分析,氧化還原反應滴定的計算,難度中等,注意利用關系式計算的計算.


 心算口算巧算一課一練系列答案
心算口算巧算一課一練系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | >100 mL | B. | =100 mL | C. | <100 mL | D. | 不能確定 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

 ,丁分子的結構式為H-$\stackrel{\stackrel{H}{/}}{N}$-$\stackrel{\stackrel{H}{/}}{N}$-H,丙屬于極性分子(填“極性”或“非極性”)
,丁分子的結構式為H-$\stackrel{\stackrel{H}{/}}{N}$-$\stackrel{\stackrel{H}{/}}{N}$-H,丙屬于極性分子(填“極性”或“非極性”)查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 氯乙烷跟化合物之間的轉化如圖所示:
氯乙烷跟化合物之間的轉化如圖所示:查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 工業設計用CO2來生產燃料甲醇,既減少二氧化碳氣體,又得到了寶貴的能源物質.為了探究反應原理,先進行如下實驗:在體積為1L的恒容密閉容器中,充入1mol CO2和3mol H2,在某溫度下發生反應:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);△H=-49.0kJ/mol.測得CO2和CH3OH(g)的濃度隨時間變化如圖所示.
工業設計用CO2來生產燃料甲醇,既減少二氧化碳氣體,又得到了寶貴的能源物質.為了探究反應原理,先進行如下實驗:在體積為1L的恒容密閉容器中,充入1mol CO2和3mol H2,在某溫度下發生反應:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);△H=-49.0kJ/mol.測得CO2和CH3OH(g)的濃度隨時間變化如圖所示.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
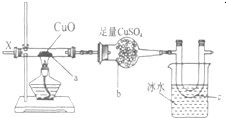 按圖裝置,持續通入X氣體,可以看到a處有紅色物質生成,b處變藍,c處得到刺激性氣味的液體,則X氣體可能是( )
按圖裝置,持續通入X氣體,可以看到a處有紅色物質生成,b處變藍,c處得到刺激性氣味的液體,則X氣體可能是( )| A. | ①③ | B. | ① | C. | ③④ | D. | ⑤ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 增大壓強一定能加快化學反應速率 | |
| B. | 使用催化劑,使反應的活化能降低,反應速率加快,平衡右移 | |
| C. | 減小反應物濃度可以減小化學反應速率常數,從而減小化學反應速率 | |
| D. | 升高溫度,活化分子百分數增大,有效碰撞次數增多,化學反應速率加快 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com