

科目:高中化學 來源: 題型:閱讀理解
 (2011?松江區模擬)運用化學反應原理研究氮、硫、氯、碘等單質及其化合物的反應有重要意義.
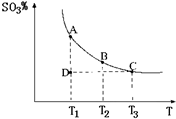
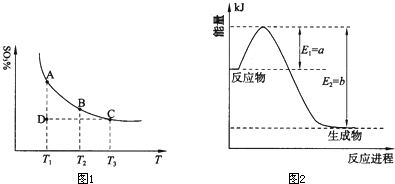
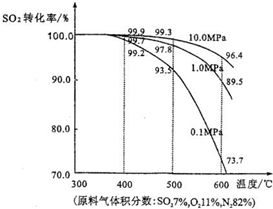
(2011?松江區模擬)運用化學反應原理研究氮、硫、氯、碘等單質及其化合物的反應有重要意義. 2SO3(g),混合體系中SO3的百分含量和溫度的關系如圖所示(曲線上任何一點都表示平衡狀態).根據圖示回答下列問題:
2SO3(g),混合體系中SO3的百分含量和溫度的關系如圖所示(曲線上任何一點都表示平衡狀態).根據圖示回答下列問題: 2SO3(g)是
2SO3(g)是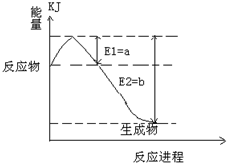
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
| 10-7b |
| a-b |
| 10-7b |
| a-b |
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
| 481a |
| 304 |
| 481a |
| 304 |
查看答案和解析>>
科目:高中化學 來源:模擬題 題型:填空題




查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
運用化學反應原理研究氮、硫、氯、碘等單質及其化合物的反應有重要意義。
(1)硫酸生產中,SO2催化氧化生成SO3:![]()
![]() 混合體系中SO3的百分含量和溫度的關系如下圖所示(曲線上任何一點都表示平衡狀態)。根據圖示回答下列問題:
混合體系中SO3的百分含量和溫度的關系如下圖所示(曲線上任何一點都表示平衡狀態)。根據圖示回答下列問題:
 ①
①![]() 的△H 0(填“>”
的△H 0(填“>”
或“<”);若在恒溫、恒壓條件下向上述平衡體系中 通入氦氣,平衡 移動(填“向左”、“向右”或“不”);
②若溫度為T1、T2,反應的平衡常數分別為K1、K2,
則K1 K2;反應進行到狀態D時,V正 v逆
(填“>”、“<”或“=)
 (2)氮是地球上含量豐富的一種元素,氮及其化合物在工農業生產、生活中有著重要作用。
(2)氮是地球上含量豐富的一種元素,氮及其化合物在工農業生產、生活中有著重要作用。
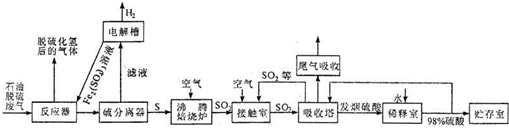
①右圖是一定的溫度和壓強下是N2和H2反應生成1molNH3過程中能量變化示意圖,請寫出工業合成氨的熱化學反應方程式: 。(△H的數值用含字母Q1、Q2的代數式表示)
②氨氣溶于水得到氨水。在25°C下,將a mol·L-1的氨水與
b mol·L-1的鹽酸等體積混合,反應后溶液中顯中性,則:
c(NH+4) c(Cl-)(填“>”、“<”或“=”);用含a和b的代數式表示該混合溶液中一水合出氨的電離平衡常數表達式 。
(3)1000℃時,硫酸鈉與氫氣發生下列反應:
Na2SO4(s) + 4H2(g) ![]() Na2S(s) + 4H2O(g) 。
Na2S(s) + 4H2O(g) 。
①該反應的平衡常數表達式為____________________。已知K1000℃<K1200℃,則該反應是________反應(填“吸熱”或“放熱”)。
②用有關離子方程式說明上述反應所得固體產物的水溶液的酸堿性
(4)25℃時,已知NH4A溶液為中性,又知將HA溶液加到Na2CO3溶液中有氣體放出,試推斷(NH4)2CO3溶液的pH 7(填<、>、=);相同溫度下,等物質的量濃度的下列鹽溶液按pH由大到小的排列順序為 。(填序號)
a..NH4HCO3 b.NH4A c.(NH4)2CO3 d.NH4Cl
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com