
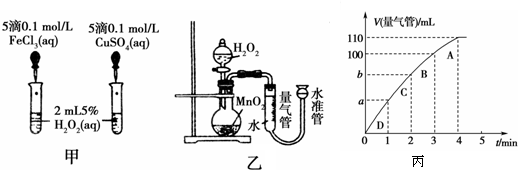
催化劑在生產和科技領域起到重大作用。為比較Fe3+和Cu2+對H2O2分解的催化效果,某化學研究小組的同學分別設計了如圖甲、乙所示的實驗。請回答相關問題:

(1)定性分析:如圖甲可通過觀察 ,定性比較得出結論。同學X觀察甲中兩支試管產生氣泡的快慢,由此得出Fe3+和Cu2+對H2O2分解的催化效果,其結論________(填“合理”或“不合理”),理由是______________________。
(2)定量分析:如圖乙所示,實驗時均以生成40 mL氣體為準,其它可能影響實驗的因素均已忽略。實驗中需要測量的數據是 。
(3)加入0.10 mol MnO2粉末于50 mL H2O2溶液中,在標準狀況下放出氣體的體積和時間的關系如圖所示。

①實驗時放出氣體的總體積是 mL。
②放出1/3氣體所需時間為 min。
③計算H2O2的初始物質的量濃度_____________。 (請保留兩位有效數字)
④A、B、C、D各點反應速率快慢的順序為_____>____>____>____。
⑤ 解釋④反應速率變化的原因 ___ _____。
(共14分)
(1)產生氣泡的快慢(2分), 不合理(2分) 陰離子種類不同(2分)
(2)產生40mL氣體所需的時間(1分)
①60 mL (1分); ②1 min (1分) ;③ 0.11 mol·L-1(2分);
④D>C>B>A (1分); ⑤隨著反應的進行,濃度減小,反應速率減慢 (2分)
【解析】
試題分析:(1)甲中催化劑不同,則可以通過產生氣泡的快慢定性比較得出結論。由于加入的鹽中陰離子不同,所以不能通過觀察甲中兩支試管產生氣泡的快慢,得出Fe3+和Cu2+對H2O2分解的催化效果。
(2)要比較外界條件對反應速率的影響,則需要測定產生40mL氣體所需的時間來進行定量測定和計算。
(3)①根據圖像可知,實驗時放出氣體的總體積是60ml。
②放出1/3氣體大約是20ml,所需時間為1min。
③最終生成氧氣的體積是60ml,物質的量是0.06L÷22.4L/mol=0.0027mol
雙氧水分解的方程式是
2H2O2=2H2O+O2↑
2mol 1mol
0.0054 0.0027
所以雙氧水的濃度是0.0054mol÷0.05L=0.11 mol·L-1
④反應速率越快,斜率越大,則A、B、C、D各點反應速率快慢的順序為D>C>B>A。
⑤由于隨著反應的進行,反應物濃度逐漸減小,反應速率減慢。
考點:本題考查外界條件對反應速率影響的實驗探究
點評:該題是中等難度的試題,試題基礎性強,在注重對學生基礎知識鞏固和訓練的同時,側重對學生能力的培養。有利于培養學生規范嚴謹的實驗設計能力,有助于提升學生的學科素養。解答時須理清化學反應速率與催化劑間的關系以及速率與圖象間的關系。


科目:高中化學 來源: 題型:

查看答案和解析>>
科目:高中化學 來源:2012-2013學年安徽省泗縣二中高二下學期期末考試化學試卷(帶解析) 題型:實驗題
催化劑在生產和科技領域起到重大作用。為比較Fe3+和Cu2+對H2O2分解的催化效果,某化學研究小組的同學分別設計了如圖甲、乙所示的實驗。請回答相關問題: 
(1)定性分析:如圖甲可通過觀察 ,定性比較得出結論。同學X觀察甲中兩支試管產生氣泡的快慢,由此得出Fe3+和Cu2+對H2O2分解的催化效果,其結論________(填“合理”或“不合理”),理由是______________________。
(2)定量分析:如圖乙所示,實驗時均以生成40 mL氣體為準,其它可能影響實驗的因素均已忽略。實驗中需要測量的數據是 。
(3)加入0.10 mol MnO2粉末于50 mL H2O2溶液中,在標準狀況下放出氣體的體積和時間的關系如圖所示。
①實驗時放出氣體的總體積是 mL。
②放出1/3氣體所需時間為 min。
③計算H2O2的初始物質的量濃度_____________。 (請保留兩位有效數字)
④A、B、C、D各點反應速率快慢的順序為_____>____>____>____。
⑤ 解釋④反應速率變化的原因 ___ _____。
查看答案和解析>>
科目:高中化學 來源:2015屆四川省外語實驗學校高一5月月考化學試卷(解析版) 題型:實驗題
催化劑在生產和科技領域起到重大作用。為比較Fe3+和Cu2+對H2O2分解的催化效果,某化學研究小組的同學分別設計了如圖甲、乙所示的實驗。請回答相關問題:

(1)定性分析:如圖甲可通過觀察 ,定性比較得出結論。同學乙觀察甲中兩支試管產生氣泡的快慢,由此得出Fe3+和Cu2+對H2O2分解的催化效果,其結論__________(填“合理”或“不合理”),理由是____________________________。
(2)定量分析:如圖乙所示,實驗時均以生成40 mL氣體為準,其它可能影響實驗的因素均已忽略。實驗中需要測量的數據是 。
(3)加入0.10 mol MnO2粉末于50 mL H2O2溶液中,在標準狀況下放出氣體的體積和時間的關系如下圖所示。

①實驗時放出氣體的總體積是 mL。
②放出1/3氣體所需時間為 min。
③計算H2O2的初始物質的量濃度______。(請保留兩位有效數字)
④A、B、C、D各點反應速率快慢的順序為_____>____>___> ____。
⑤解釋反應速率變化的原因 。
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
查看答案和解析>>
科目:高中化學 來源:2012-2013學年山東省臨沂市臨沭實驗中學高二(上)期中化學試卷(解析版) 題型:填空題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com