
 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑ Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑

科目:高中化學 來源: 題型:閱讀理解
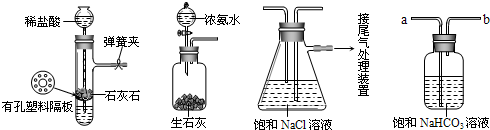
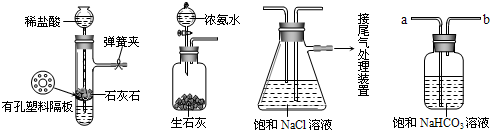
 (2011?萬州區一模)硫酸工廠周圍的空氣中有較多的二氧化硫.某研究性學習小組為了測定空氣(內含N2、O2、CO2、SO2等)中二氧化硫的體積分數設計了如下實驗方案,如圖是他們在測定中使用的部分裝置圖.
(2011?萬州區一模)硫酸工廠周圍的空氣中有較多的二氧化硫.某研究性學習小組為了測定空氣(內含N2、O2、CO2、SO2等)中二氧化硫的體積分數設計了如下實驗方案,如圖是他們在測定中使用的部分裝置圖.| 22.4m |
| 233V |
| 22.4m |
| 233V |
查看答案和解析>>
科目:高中化學 來源: 題型:
| ||
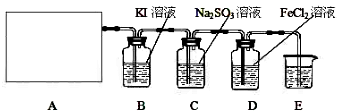
查看答案和解析>>
科目:高中化學 來源: 題型:
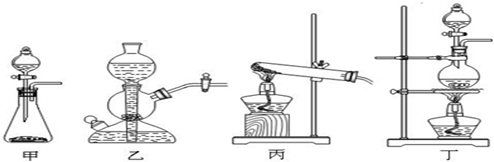
| ||
| ||
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解

| 8000×(15-cV2) |
| V1 |
| 8000×(15-cV2) |
| V1 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com