
(10分)某研究性學習小組用電解 溶液的方法測定銅的相對原子質量(裝置如圖),實驗中測得某電極的質量增重為m g,已知氧元素相對原子質量為16。請回答:
溶液的方法測定銅的相對原子質量(裝置如圖),實驗中測得某電極的質量增重為m g,已知氧元素相對原子質量為16。請回答:
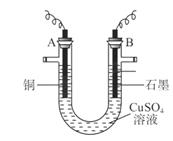
(1)m g應為 極的質量增重(填A或B),電解總反應的離子方程式為 ;
(2)本實驗(電解 溶液)中,學習小組采用兩套方案測定銅的相對原子質量。
溶液)中,學習小組采用兩套方案測定銅的相對原子質量。
①第一套方案中,同學們測得氣體的體積為V L(標準狀況),則銅的相對原子質量是(用m、V表示) ;
②第二套方案中,以下數據需要測定的是(填序號) 。
a. A極增加的質量 b. 整套裝置減少的質量
c. 電解后溶液的體積 d. 電解后溶液的pH(可由此計算出溶液中H+的物質的量濃度)
(1)A
2CuSO4+2H2O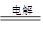 2Cu+2H2SO4+O2↑ (2) ①
2Cu+2H2SO4+O2↑ (2) ① ②ab或acd
②ab或acd
【解析】(1)析出的金屬應該是銅,所以應該在陰極,即在A電極析出;石墨是陽極,溶液中的OH-放電,所以總的方程式是2CuSO4+2H2O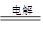 2Cu+2H2SO4+O2↑。
2Cu+2H2SO4+O2↑。
(2)①VL是氧氣的體積,在氧氣的物質的量是V/22.4mol。因此根據方程式可知,生成銅是V/11.2mol。所以銅的相對原子質量是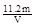 。
。
②要計算銅的相對原子質量,則需要計算析出銅的質量和銅物質的量。根據方程式可知,要計算銅的物質的量,可以通過溶液減少的質量來計算生成的氧氣質量;或者通過計算生成的硫酸的物質的量,因此正確的答案是ab或acd。


科目:高中化學 來源:2011-2012學年江西省興國縣將軍中學高二上學期期中考試化學試卷 題型:實驗題
(10分)某研究性學習小組為了探究醋酸的電離情況,進行了如下實驗。
實驗一 配制醋酸溶液的濃度取冰醋酸配制250 mL 0.2 mol/L的醋酸溶液,用0.2 mol/L的醋酸溶液稀釋成所需濃度的溶液,再用NaOH標準溶液對所配醋酸溶液的濃度進行標定。回答下列問題:
配制250 mL 0.2 mol/L 醋酸溶液時需要用到的玻璃儀器有量筒、燒杯、玻璃棒、________________和_________________。
實驗二 探究濃度對醋酸電離程度的影響
用pH計測定25℃時不同濃度的醋酸的pH,其結果如下:
| 醋酸濃度(mol/L) | 0.0010 | 0.0100 | 0.0200 | 0.1000 | 0.2000 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
 ____________________________________
____________________________________查看答案和解析>>
科目:高中化學 來源:2012-2013學年河南省南陽市一中高二第一次月考化學試卷(帶解析) 題型:實驗題
(10分)某研究性學習小組用電解 溶液的方法測定銅的相對原子質量(裝置如圖),實驗中測得某電極的質量增重為m g,已知氧元素相對原子質量為16。請回答:
溶液的方法測定銅的相對原子質量(裝置如圖),實驗中測得某電極的質量增重為m g,已知氧元素相對原子質量為16。請回答: 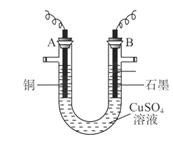
(1)m g應為 極的質量增重(填A或B),電解總反應的離子方程式為 ;
(2)本實驗(電解 溶液)中,學習小組采用兩套方案測定銅的相對原子質量。
溶液)中,學習小組采用兩套方案測定銅的相對原子質量。
①第一套方案中,同學們測得氣體的體積為V L(標準狀況),則銅的相對原子質量是(用m、V表示) ;
②第二套方案中,以下數據需要測定的是(填序號) 。
a. A極增加的質量 b. 整套裝置減少的質量
c. 電解后溶液的體積 d. 電解后溶液的pH(可由此計算出溶液中H+的物質的量濃度)
查看答案和解析>>
科目:高中化學 來源:2012屆河北省石家莊市高三上學期教學質量檢測化學試卷 題型:實驗題
(10分)某研究性學習小組為探究Cu(OH)2受熱分解產物及產物性質,設計如下實驗。
(1)取0.98 g Cu(OH)2固體加熱,質量隨溫度變化的曲線如圖1所示,產物A、B的化學式分別為 和 。
(2)取少量產物B加入足量的稀硫酸,得到藍色溶液,同時觀察到容器中還有紅色固體存在,該反應的離子方程式為 。
(3)為證明產物A在加熱時能與NH3反應,某同學設計了如圖Ⅱ(夾持裝置未畫出)所示實驗裝置。
①簡述檢查該裝置氣密性的方法 。
②實驗過程中觀察到兩個明顯現象: i直玻璃管中固體由黑色變為紅色;ii裝置乙中固體由白色變為藍色。能證明產物A與NH3發生了反應的判斷依據的是 (填選項字母)。
a.只有i可以 b.只有ii可以 c.i或ii都可以
查看答案和解析>>
科目:高中化學 來源:2011-2012學年陜西省高三第三次月考化學試卷(解析版) 題型:實驗題
(10分) 某研究性學習小組對過量炭粉與氧化鐵(Fe2O3)反應的氣體產物成分進行研究。
(1)提出假設
①氣體產物是CO2。 ②氣體產物是CO。 ③氣體產物是 。
(2)設計方案
如圖所示,將一定量的氧化鐵在隔絕空氣的條件下與過量炭粉完全反應,測定參加反應的碳元素與氧元素的質量比。
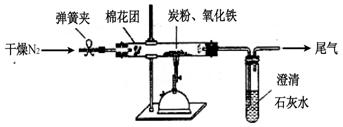
(3)查閱資料
氮氣不與碳、氧化鐵發生反應。實驗室可以用氯化銨飽和溶液和亞硝酸鈉(NaNO2)飽和溶液混合加熱反應制得氮氣,該反應的離子方程式: 。
(4)實驗步驟
①按上圖連接裝置,并檢查裝置的氣密性,稱取3.20g氧化鐵、0.48g碳粉混合均勻,放入50.00g的硬質玻璃管中;
②加熱前,先通一段時間純凈干燥的氮氣;
③停止通入N2后,夾緊彈簧夾,加熱一段時間,澄清石灰水(足量)變渾濁;
④待反應結束,再緩緩通入一段時間的氮氣。冷卻至室溫,稱得硬質玻璃管和固體總質量為52.24g;
⑤過濾出石灰水中的沉淀,洗滌、烘干后稱得質量為2.00g。
步驟②、④中都分別通入N2,其作用分別為 。
(5)數據處理
試根據實驗數據分析判斷,前面的假設_________(填①、②、③)是正確的。寫出該實驗中氧化鐵與碳發生反應的化學方程式: 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com