
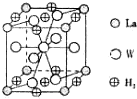
 有A、B、C、D、E、F、G、W八種原子序數依次增大的元素(原子序數均小于30),A原子的核外電子數與電子層數相等,B的基態原子有3個不同的能級且各能級中電子數相等,D的基態原子與B的基態原子的未成對電子數目相同,E的基態原子s能級的電子總數與p能級的電子數相等,E、F同主族,G與W同周期同族且原子序數相差2.請回答下列問題:
有A、B、C、D、E、F、G、W八種原子序數依次增大的元素(原子序數均小于30),A原子的核外電子數與電子層數相等,B的基態原子有3個不同的能級且各能級中電子數相等,D的基態原子與B的基態原子的未成對電子數目相同,E的基態原子s能級的電子總數與p能級的電子數相等,E、F同主族,G與W同周期同族且原子序數相差2.請回答下列問題:分析 A、B、C、D、E、F、G、W八種元素的原子序數依次增大,A原子的核外電子數與電子層數相等,則A為H元素;B的基態原子有3個不同的能級,且各能級中的電子數相等,原子核外電子排布式為1s22s22p2,故B為C元素;E的基態原子s能級的電子總數與p能級的電子數相等,原子核外電子排布式為1s22s22p4或1s22s22p63s2;D的基態原子與B的基態原子的未成對電子數目相同,D的原子序數小于E,的原子核外電子排布只能為1s22s22p4,則D為O元素、故F為Mg;C的原子序數介于碳、氧之間,則C為N元素;E、F同主族,則F為Ca;G與W同周期同族且原子序數相差2,則G為Fe、W為Ni.
解答 解:A、B、C、D、E、F、G、W八種元素的原子序數依次增大,A原子的核外電子數與電子層數相等,則A為H元素;B的基態原子有3個不同的能級,且各能級中的電子數相等,原子核外電子排布式為1s22s22p2,故B為C元素;E的基態原子s能級的電子總數與p能級的電子數相等,原子核外電子排布式為1s22s22p4或1s22s22p63s2;D的基態原子與B的基態原子的未成對電子數目相同,D的原子序數小于E,的原子核外電子排布只能為1s22s22p4,則D為O元素、故F為Mg;C的原子序數介于碳、氧之間,則C為N元素;E、F同主族,則F為Ca;G與W同周期同族且原子序數相差2,則G為Fe、W為Ni.
(1)G為Fe,基態原子的核外電子排布為1s22s22p63s23p63d64s2,價電子排布式為:3d64s2,
同周期隨原子序數增大,元素的第一電離能呈增大趨勢,氮元素2p能級為半滿穩定狀態,第一電離能高于同周期相鄰元素的,故第一電離能N>O>C,N原子核外電子數排布為1s22s22p3,有3種不同能級的電子,CH3+中C原子雜化軌道數目為3+$\frac{4-1-1×3}{4}$=3,C原子的雜化方式為sp2雜化,
故答案為:3d64s2;3;sp2雜化;
(2)a.B2A2分子為C2H2,乙炔分子中中含有1個σ鍵和2個π鍵,故a正確;
b.A2D2分子為H2O2,雙氧水分子之間形成氫鍵,沸點高于C2H2的,故b正確;
c.H2O2分子是每個氧原子含有2個共用電子對且含有2個孤電子對,所以其價層電子對數是4,氧原子采用sp3雜化,所以其空間構型為展開書頁型,故c錯誤;
d.同周期自左而右電負性增大,故電負性O>N>C,故d正確;
e.元素B、C的最高價氧化物的水化物分別為碳酸、硝酸,硝酸的酸性比碳酸的強,故e正確;
f.CaO晶體、MgO晶體均為離子晶體,離子所帶電荷相同,鎂離子半徑小于鈣離子的,故MgO的晶格能更大,則MgO的熔點比CaO的高,故f錯誤,
故選:cf;
(3)FeCl3溶液與KSCN溶液混合,得到含多種配合物的血紅色溶液,其中配位數為5的配合物的化學式是K2[Fe(SCN)5],
故答案為:K2[Fe(SCN)5];
(4)晶胞中W原子數目為1+8×$\frac{1}{2}$=5,氫氣分子數目為8×$\frac{1}{4}$+2×$\frac{1}{2}$=3,含0.5mol W的合金可吸附氫氣為0.5mol×$\frac{3}{5}$=0.3mol,標況下吸收氫氣體積為0.3mol×22.4L/mol=6.72L,
故答案為:6.72L.
點評 本題是對物質結構與性質的考查,題目涉及核外電子排布、雜化方式與空間構型、電負性、元素周期律、晶體類型與性質、配合物、晶胞計算等,是對物質結構主干知識的考查,充分考查了學生的分析、理解能力.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鋁鈉合金是混合物 | |
| B. | 鋁鈉合金若投入一定的水中可得無色溶液,則n(Al)≤n(Na) | |
| C. | 鋁鈉合金投入到足量氯化銅溶液中,肯定有氫氧化銅沉淀也可能有銅析出 | |
| D. | 若mg不同組成的鋁鈉合金投入足量鹽酸中,放出的H2越多,則鋁的質量分數越小 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
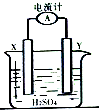 某同學進行如圖所示的銅--鋅原電池實驗,已知電解質溶液中H+向X極移動.
某同學進行如圖所示的銅--鋅原電池實驗,已知電解質溶液中H+向X極移動.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
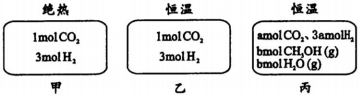
| A. | 剛開始反應時速率:甲>乙 | B. | 平衡后反應放熱:甲>乙 | ||
| C. | 500℃下該反應平衡常數:K=3×102 | D. | 若a≠0,則0.9<b<l |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
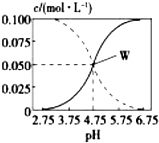 25℃時,由醋酸和醋酸鈉按一定比例混合形成的溶液始終保持c(CH3COOH)+c(CH3COO-)=0.1mol/L,該溶液中c(CH3COOH)、c(CH3COO-)與pH的關系如圖所示,下列有關該溶液的敘述中正確的是( )
25℃時,由醋酸和醋酸鈉按一定比例混合形成的溶液始終保持c(CH3COOH)+c(CH3COO-)=0.1mol/L,該溶液中c(CH3COOH)、c(CH3COO-)與pH的關系如圖所示,下列有關該溶液的敘述中正確的是( )| A. | pH=5的溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) | |
| B. | W點所表示的溶液中:c(Na+)=c(CH3COOH) | |
| C. | pH=3的溶液中:c(H+)+c(Na+)+c(CH3COOH)=0.1mol/L | |
| D. | 據圖象可求得該溫度下CH3COOH的電離常數Ka=10-4.75 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 工業上用水吸收NO2生產硝酸:3NO2+H2O=2HNO3+NO | |
| B. | 用熟石灰處理泄漏的液氯:2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O | |
| C. | Cu與稀硝酸反應制取硝酸銅:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O | |
| D. | 用明礬除去水中的懸浮顆粒物:Al3++3H2O?Al(OH)3(膠體)+3H+ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 我國科學家屠呦呦因發現治療瘧疾的特效藥青蒿素而獲諾貝爾生理醫學獎.青蒿素的結構如圖所示,有關青蒿素的說法不正確的是( )
我國科學家屠呦呦因發現治療瘧疾的特效藥青蒿素而獲諾貝爾生理醫學獎.青蒿素的結構如圖所示,有關青蒿素的說法不正確的是( )| A. | 青蒿素分子式為C15H22O5 | |
| B. | 青蒿素分子內的過氧基團是對付瘧原蟲的核心基團 | |
| C. | 青蒿素能夠發生水解反應 | |
| D. | 青蒿素分子中有6個手性碳原子 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題


| H2C204 | Ka1=5.36×10-2 | Ka2=5.35×10-5 |
| HF | Ka=6.32×10-4 | |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com