
周期表中前36號元素A、B、C、D、E、F、G、H,它們的原子序數依次增大,其中B、C、D為同一周期;E、F、G為同一周期;A和E、D和G分別為同一主族;A與B組成的化合物是一種溫室氣體;D元素原子的最外層電子數是次外層電子數的3倍;E是所在周期原子半徑最大的元素(除稀有氣體外);F元素的離子半徑是同周期元素形成的簡單離子中最小的;H元素基態原子的M層全充滿,N層沒有成對電子,只有一個未成對電子。
(1)E2D2物質中化學鍵的類型是__________________
(2)一定條件下,A2氣體與C2氣體充分反應可生成6.8 g的氣體,放出18.44 kJ熱量,則該反應的熱化學方程式為:_________________________________________;生成物分子的空間構型為_________________,其中C的雜化方式為_______________。
(3)C和E組成的一種離子化合物,能與水反應生成兩種堿,該反應的化學方程式是
。
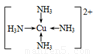
(4)H的基態原子的電子排布式為__________________________已知H2+能與(2)中的生成物的水溶液形成配合物,請寫出該配合物中陽離子的結構簡式:_________________,在此配合物的水溶液中加入乙醇,現象是_______________________________________。
(5)將足量的GD2通入EDA溶液中所得溶液的離子濃度的大小順序為:
(1)非極性共價鍵、離子鍵
(2)N2(g)+3H2(g) 2NH3(g);△H=-92.2kJ/mol
三角錐形
sp3雜化
2NH3(g);△H=-92.2kJ/mol
三角錐形
sp3雜化
(3)Na3N + 4H2O=3NaOH + NH3·H2O
(4)1s22s22p63s23p63d104s1
 有深藍色晶體析出
有深藍色晶體析出
(5)c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-)
【解析】
試題分析:根據題干信息:A是氫、B是碳、C是氮、D是氧、E是鈉、F是鋁、G是硫、H是銅。
(1)Na2O2中含有非極性共價鍵和離子鍵。
(2)信息表示合成氨的熱化學方程式。
(3)Na3N能與水反應生成兩種的堿NaOH和NH3·H2O
(4)Cu離子可以與水形成四水合銅配合物。
(4)將足量的SO2通入NaOH溶液中所得溶液為NaHSO3溶液,HSO3-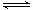 H++SO32-,HSO3-+H2O
H++SO32-,HSO3-+H2O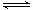 H2SO3+OH-,HSO3-電離的程度大于水解的程度,溶液呈酸性,溶液中各離子間的關系是:c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-)
H2SO3+OH-,HSO3-電離的程度大于水解的程度,溶液呈酸性,溶液中各離子間的關系是:c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-)
考點:本題考查了元素化合物的知識,有物質的推導,熱化學方程式的書寫。


科目:高中化學 來源: 題型:
| 電離能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| D | 738 | 1451 | 7733 | 10540 |
| E | 578 | 1817 | 2745 | 11578 |


查看答案和解析>>
科目:高中化學 來源: 題型:
 已知:A、B、C、D、E、F是周期表中前36號元素,A是原子半徑最小的元素,B元素基態原子的2P軌道上只有兩個電子,C元素的基態原子L層只有2對成對電子,D是元素周期表中電負性最大的元素,E2+的核外電子排布和Ar原子相同,F的核電荷數是D和E的核電荷數之和.
已知:A、B、C、D、E、F是周期表中前36號元素,A是原子半徑最小的元素,B元素基態原子的2P軌道上只有兩個電子,C元素的基態原子L層只有2對成對電子,D是元素周期表中電負性最大的元素,E2+的核外電子排布和Ar原子相同,F的核電荷數是D和E的核電荷數之和.| 5.2×10-22 |
| ρ |
| 5.2×10-22 |
| ρ |
查看答案和解析>>
科目:高中化學 來源: 題型:
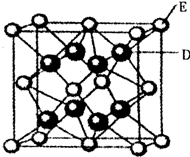
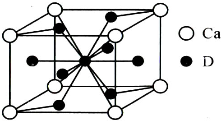 (5)鑭鎳合金與上述合金都具有相同類型的晶胞結構XYn,它們有很強的儲氫能力.已知鑭鎳合金LaNin晶胞體積為9.0×10-23 cm3,儲氫后形成LaNinH4.5合金(氫進入晶胞空隙,體積不變),則LaNin中n=
(5)鑭鎳合金與上述合金都具有相同類型的晶胞結構XYn,它們有很強的儲氫能力.已知鑭鎳合金LaNin晶胞體積為9.0×10-23 cm3,儲氫后形成LaNinH4.5合金(氫進入晶胞空隙,體積不變),則LaNin中n=查看答案和解析>>
科目:高中化學 來源: 題型:
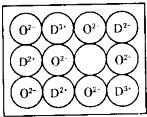 【化學-選修物質結構與性質】
【化學-選修物質結構與性質】查看答案和解析>>
科目:高中化學 來源:09-10年如皋市高二下學期期末考試化學卷 題型:填空題
(12分)已知A、B、C、D、E、F均為周期表中前36號元素,且原子序數依次增大。A、B、C為同一周期的主族元素,B原子p能級電子總數與s能級電子總數相等。A、F原子未成對電子是同周期中最多的,且F基態原子中電子占據三種不同形狀的原子軌道。D和E原子的第一至第四電離能如下表所示:
| 電離能/ kJ·mol-1 | I1 | I2 | I3 | I4 |
| D | 738 | 1451 | 7733 | 10540 |
| E | 578 | 1817 | 2745 | 11578 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com