
 碳和碳的化合物在生產、生活中的應用非常廣泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一種理想,更是一種值得期待的新的生活方式.
碳和碳的化合物在生產、生活中的應用非常廣泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一種理想,更是一種值得期待的新的生活方式.| 實驗組 | 溫度/℃ | 起始量/mol | 平衡量/mol | 達到平衡所需時間/min | |
| H2O | CO | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 3 |
| 3 | 900 | 1 | 2 | 0.4 | 1 |
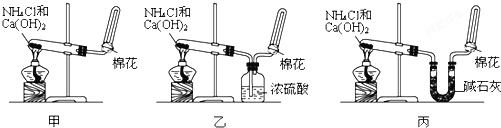
分析 (1)①依據熱化學方程式和蓋斯定律計算得到所需熱化學方程式,①-②×3得到所需熱化學方程式;
②根據氧化還原反應規律,CO與PdCl2溶液反應,PdCl2被還原成單質,則CO被氧化成CO2,根據質量守恒定律,有水參與反應同時生成氯化氫,據此寫出反應的化學方程式即可;
(2)①根據C3H8和O2構成丙烷燃料電池的總反應:C3H8+5O2+6OH-=3CO32-+7H2O,正極發生還原反應,電極反應式為:O2+4e-+2H2O=4OH-,而負極電極反應式=總反應方程式-正極的電極反應式來解答;
②A、B端析出氫氣可驅趕原溶液中溶解的少量氧氣;
B、電解液選用NaCl溶液不影響實驗,因為陽極是鐵失電子生成亞鐵離子,溶液中的陰離子不放電;
C、陽極應該用鐵電極,陰極用惰性電極亦可;
D、B電極反應是陰極氫離子放電生成氫氣;
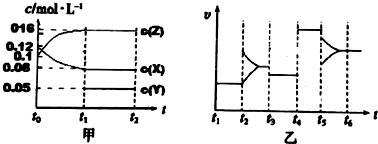
(3)①比較第二組的第一組反應物的轉化率大小以及溫度對化學平衡和轉化率的影響來判斷;
②首先利用三段式計算出平衡時各物質的濃度,根據K=$\frac{c(C{O}_{2})•c({H}_{2})}{c(CO)•c({H}_{2}O)}$計算;
③實驗3跟實驗2相比,溫度相同,濃度相同,但實驗3達到平衡所用時間少,反應速率更大,但平衡狀態沒有發生移動.
解答 解:(1)①.已知①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1
②C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJ•mol-1
依據蓋斯定律①-②×3得到熱化學方程式為:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5 kJ•mol-1;
故答案為:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5 kJ•mol-1;
②氧化還原反應規律,CO與PdCl2溶液反應,PdCl2被還原成單質,則CO被氧化成CO2,根據質量守恒定律,有水參與反應同時生成氯化氫,反應的化學方程式為:PdCl2+CO+H2O=Pd+CO2+2HCl,故答案為:PdCl2+CO+H2O=Pd+CO2+2HCl;
(2)C3H8和O2構成丙烷燃料電池的總反應:C3H8+5O2+6OH-=3CO32-+7H2O,正極發生還原反應,電極反應式為:O2+4e-+2H2O=4OH-,負極發生氧化反應,電極反應式為:C3H8 +26OH--20e-=3CO32-+17H2O;故答案為:C3H8 +26OH--20e-=3CO32-+17H2O;
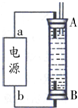
②A、因為生成的氫氣將裝置中原有氧氣溢出,所以氫氣從B端陰極析出,A電極則是鐵做陽極失去電子生成亞鐵離子,電源中的a與A相連,則a為正極,b與B相連,則b為負極,故A正確;
B、電解池中陽極是鐵失去電子發生氧化反應生成亞鐵離子,陰極是溶液中的氫離子得電子發生還原反應,所以電解質溶液中的陰離子不會在陽極失電子,所以選用NaCl溶液不影響實驗,故B正確;
C、陽極應該用鐵電極,陰極可以是鐵也可以是其他惰性電極,故C錯誤;
D、陰極氫離子放電,其電極反應為2H++2e-=H2↑,故D正確;
故選:ABD;
(3)①實驗1中CO的轉化率為$\frac{1.6mol}{4mol}$×100%=40%,實驗2中CO的轉化率為$\frac{0.4mol}{2mol}$×100%=20%,則實驗1的轉化率大于實驗2,則說明溫度升高平衡向逆反應方向移動,正反應放熱,故答案為:放熱;
②H2O(g)+CO(g)  CO2(g)+H2(g)
CO2(g)+H2(g)
初始 1mol/L 2mol/L 0 0
轉化 0.4mol/L 0.4mol/l 0.4mol/l 0.4mol/l
平衡 0.6mol/L 1.6mol/L 0.4mol/l 0.4mol/l
根據K=$\frac{c(C{O}_{2})•c({H}_{2})}{c(CO)•c({H}_{2}O)}$=$\frac{0.4×0.4}{0.6×1.6}$=$\frac{1}{6}$,
故答案為:$\frac{1}{6}$;
③實驗3跟實驗2相比,溫度相同,濃度相同,但實驗3達到平衡所用時間少,反應速率更大,但平衡狀態沒有發生移動,應是使用了催化劑,又由于反應前后氣體體積不變,則增大了壓強,平衡也不移動,也可能為壓強的增大,
故答案為:使用了催化劑或增大了壓強.
點評 本題考查熱化學方程式、電極反應的書寫以及化學平衡的計算等,做題時注意把握影響平衡移動的因素以及平衡常數的有關計算,題目難度中等,側重于考查學生的分析能力和計算能力.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①③⑤ | B. | ②④ | C. | ①③ | D. | ③⑤ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 2NH3.
2NH3.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氫氟酸具有強酸性,可用于雕刻玻璃 | |
| B. | 濃硫酸具有吸水性,可用濃硫酸干燥SO2、H2S、NO2等氣體 | |
| C. | 常溫下,鋁比鐵耐腐蝕,可用鋁鍋長期盛放酸性食物 | |
| D. | 氨氣與氯氣能反應生成氯化銨,可用濃氨水檢驗輸送氯氣的管道是否有泄漏 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Y的離子半徑比X的離子半徑大 | |
| B. | 化合物Y2Z中既有離子鍵、又有共價鍵 | |
| C. | Y、W最高價氧化物對應水化物的溶液均能溶解氧化鋁 | |
| D. | 簡單氣態氫化物的穩定性由強到弱的順序:Z、W、X |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com