
【題目】中國海軍航母建設正在有計劃、有步驟向前推進,第一艘國產航母目前正在進行海試。建造航母需要大量的新型材料。航母的龍骨要耐沖擊,航母的甲板要耐高溫,航母的外殼要耐腐蝕。
(1)鎳鉻鋼抗腐蝕性能強,Ni2+基態原子的核外電子排布為_______,鉻元素在周期表中______區。
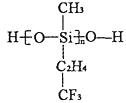
(2)航母甲板涂有一層耐高溫的材料聚硅氧烷結構如圖所示,其中C原子雜化方式為_______雜化。
(3)海洋是元素的搖籃,海水中含有大量鹵族元素。
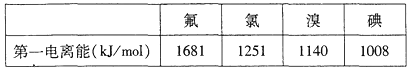
①根據下表數據判斷:最有可能生成較穩定的單核陽離子的鹵素原子是______填元素符號
②根據價層電子對互斥理論,預測ClO3-的空間構型為______形,寫出一個ClO3-的等電子體的化學符號______。
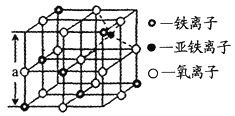
(4)海底金屬軟泥是在洋海底覆蓋著的一層紅棕色沉積物,蘊藏著大量的資源,含有硅、鐵、錳、鋅等。如右圖是從鐵氧體離子晶體Fe3O4中取出的能體現其晶體結構的一個立方體,則晶體中的離子是否構成了面心立方最密堆積?_____(填“是”或“否”);該立方體是不是Fe3O4的晶胞?______(填“是”或“否”);立方體中鐵離子處于氧離子圍成的_______(填空間結構)空隙;根據下圖計算Fe3O4晶體的密度為________g/cm3。(圖中a=0.42nm,計算結果保留兩位有效數字)
【答案】1s22s22p63s23p63d8 d sp3 Ⅰ 三角錐 SO32- 是 是 正八面體 5.2
【解析】
(1)Ni處于周期表中第四周期第ⅤⅢ族,是d區金屬元素;
(2)聚硅氧烷中C形成4個單鍵;
(3)①根據第一電離能分析,第一電離能越小,越容易生成較穩定的單核陽離子;
②根據VSEPR理論判斷ClO3-的空間構型,價電子對數為VP=BP+LP,等電子體是指原子總數相同,價電子總數也相同的微粒;
(4)根據O2-的坐標分析,根據晶胞粒子的排布,該立方體不是Fe3O4的晶胞,立方體中Fe3+處于O2-圍成的正八面體空隙,根據密度公式ρ=![]() 計算。
計算。
(1)Ni處于周期表中第四周期第ⅤⅢ族,Ni2+基態原子的核外電子排布為1s22s22p63s23p63d8,鉻元素在周期表中d區;
(2)聚硅氧烷中C形成4個單鍵,所以C的雜化方式為sp3;
(3)①根據第一電離能分析,第一電離能越小,越容易生成較穩定的單核陽離子,所以有可能生成較穩定的單核陽離子的鹵素原子是I原子;
②根據VSEPR理論判斷ClO3-的空間構型,價電子對數為VP=BP+LP=3+![]() =4,VSEPR模型為四面體形,由于一對孤電子對占據四面體的一個頂點,所以其空間構型為三角錐形,等電子體是指原子總數相同,價電子總數也相同的微粒,則與ClO3-互為等電子體的是SO32-;
=4,VSEPR模型為四面體形,由于一對孤電子對占據四面體的一個頂點,所以其空間構型為三角錐形,等電子體是指原子總數相同,價電子總數也相同的微粒,則與ClO3-互為等電子體的是SO32-;
(4)晶胞中,O2-的坐標為(![]() ,0,0),(0,
,0,0),(0,![]() ,0),(0,0,
,0),(0,0,![]() ),(
),(![]() ,
,![]() ,
,![]() ),將(
),將(![]() ,
,![]() ,
,![]() )+(
)+(![]() ,
,![]() ,0)=(0,0,
,0)=(0,0,![]() ),將(
),將(![]() ,
,![]() ,
,![]() )+(0,
)+(0,![]() ,
,![]() )=(
)=(![]() ,0,0),將(
,0,0),將(![]() ,
,![]() ,
,![]() )+(
)+(![]() ,0,
,0,![]() )=(0,
)=(0,![]() ,0),剛好與前三個坐標相同,所以O2-作面心立方最密堆積,根據晶胞粒子的排布,該立方體是Fe3O4的晶胞,立方體中Fe3+處于O2-圍成的正八面體空隙,以立方體計算,1個立方體中含有Fe3+的個數為4×
,0),剛好與前三個坐標相同,所以O2-作面心立方最密堆積,根據晶胞粒子的排布,該立方體是Fe3O4的晶胞,立方體中Fe3+處于O2-圍成的正八面體空隙,以立方體計算,1個立方體中含有Fe3+的個數為4×![]() +
+![]() ×3=2個,含有Fe2+的個數為1個,含有O2-的個數為12×
×3=2個,含有Fe2+的個數為1個,含有O2-的個數為12×![]() +1=4個,假設取1mol這樣的立方體,即有NA個這樣的立方體,1mol立方體的質量為m=(56×3+16×4)g,1個立方體體積為V=a3nm3=a3(a×10-7)3cm3,則晶體密度為ρ=
+1=4個,假設取1mol這樣的立方體,即有NA個這樣的立方體,1mol立方體的質量為m=(56×3+16×4)g,1個立方體體積為V=a3nm3=a3(a×10-7)3cm3,則晶體密度為ρ=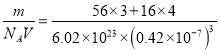 g/cm3=5.2 g/cm3。
g/cm3=5.2 g/cm3。


科目:高中化學 來源: 題型:
【題目】將30g MnO2的質量分數為76.6%的軟錳礦石與足量的濃度為12 molL-1的濃鹽酸完全反應(雜質不參加反應),試計算:
(1)參加反應的濃鹽酸的體積的大小(結果保留3位小數)。____________
(2)在標準狀況下,生成Cl2的體積的大小________ (結果保留1位小數,已知軟錳礦石與濃鹽酸反應的化學方程式為MnO2+4HCl(濃) =MnCl2+Cl2↑+2H2O)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】 NA是阿伏加德羅常數的值。下列說法正確的是
A.1L1mol/L葡萄糖水溶液中含H-O鍵的數目為5 NA
B.標準狀況下,2.24LCO2和N2O的混合氣體所含質子數為2.2 NA
C.1molCH3COOH和3molCH3CH2OH在濃硫酸催化下反應生成酯基的數目為NA
D.常溫下,28g鐵片投入足量濃硝酸中,轉移電子數為1.5 NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2一氨-3—氯苯甲酸是白色晶體,其制備流程如下:
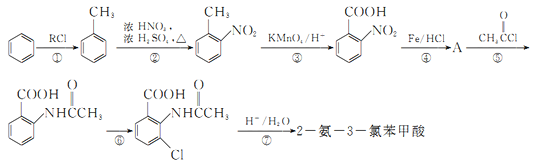
已知: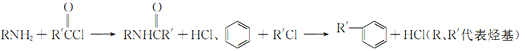
回答下列相關問題
(1)![]() 的名稱是__________,2-氨-3-氯苯甲酸中含N官能團的電子式為__________。
的名稱是__________,2-氨-3-氯苯甲酸中含N官能團的電子式為__________。
(2)反應①中R代表的是_____________,反應②的反應類型為_____________。
(3)如果反應③中KMnO4的還原產物為MnSO4,請寫出該反應的化學方程式_____________。
(4)A的結構簡式為_____________,⑥的反應條件為_____________。
(5)符合下列條件的同分異構體的結構簡式為_____________。
a.式量比![]() 大42的苯的同系物;
大42的苯的同系物;
b.與酸性KMnO4反應能生成二元羧酸
c.僅有3種等效氫
(6)事實證明上述流程的目標產物的產率很低;據此,研究人員提出將步驟⑥設計為以下三步,產率有了一定提高。
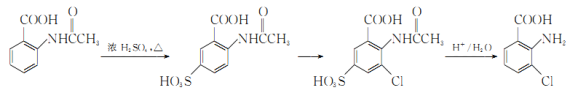
分析產率提高的原因是_____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】物質的量是高中化學常用的物理量,請完成以下有關計算:
(1)相同質量的CO和CO2,它們所含的原子數之比為___________,標準狀況下,含有相同氧原子數的CO和CO2的體積之比為_____________。
(2)若a g某氣體中含有的分子數為b,則c g該氣體在標準狀況下的體積是___________(設NA為阿伏加德羅常數的值)。
(3)標準狀況下有①0.112 L水 ②0.5NA個HCl分子 ③25.6 g SO2氣體 ④0.2 mol氨氣(NH3) ⑤2 mol Ne 所含原子個數從大到小的順序為___________。
(4)V mL Fe2(SO4)3溶液中,含有Fe 3+ m g,取出![]() mL該溶液稀釋至4V mL,則溶液中SO42-的物質的量濃度為___________________。(用含有m、V的式子表示)
mL該溶液稀釋至4V mL,則溶液中SO42-的物質的量濃度為___________________。(用含有m、V的式子表示)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用NA表示阿伏伽德羅常數的值。下列判斷正確的是( )
A.46g的NO2和N2O4的混合物所含原子總數為3NA
B.24g Mg變為Mg2+時失去的電子數目為NA
C.1mol/L CaCl2溶液中含有的Cl-離子數目為2NA
D.含有lmol FeCl3的溶液加熱中完全轉化為氫氧化鐵膠體,其中膠粒的數目為NA個
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有NaCl、Na2SO4.和NaNO3的混合物,選擇適當的試劑除去雜質,從而得到純凈的NaNO3晶體,相應的實驗流程如圖所示。
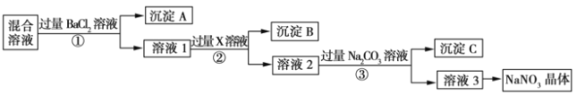
請回答下列問題:
(1)產生沉淀A的離子反應方程式是:________________________;
(2)試劑X是:____________________________________;
(3)上述實驗流程中①②③步驟中均要用到的主要玻璃儀器有____________;
(4)上述實驗流程中加入過量Na2CO3溶液產生的沉淀C是:________________________。
(5)按此實驗方案得到的溶液3中肯定含有雜質,為了解決這個問題,可以向溶液3中加入適量的____________ (填化學式),并寫出離子反應方程式:_______________________________________________。
(6)溶液3到硝酸鈉晶體需要的操作步驟是:________________________洗滌,干燥。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】我國最近在太陽能光電催化一化學耦合分解硫化氫研究中獲得新進展,相關裝置如圖所示。下列說法正確的是( )

A.該工藝中光能最終轉化為化學能
B.該裝置工作時,H+由b極區流向a極區
C.a極上發生的電極反應為Fe3++e-=Fe2+
D.a極區需不斷補充含Fe3+和Fe2+的溶液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】CoS2催化CO煙氣脫硫具有廣闊的工業化前景。回答下列問題:
(1)已知:
CoS2(s) +CO(g) ![]() CoS(s) +COS(g) H1
CoS(s) +COS(g) H1
2COS(g) +SO2(g) ![]() 3S(s) +2CO2(g) H2
3S(s) +2CO2(g) H2
S(s) +CoS(S) ![]() CoS2 (s) △H3
CoS2 (s) △H3
則2CO(g)+ SO2(g)![]() 2CO2(g)+S(s) H4=____。 (用H1、 H2、H3表示)
2CO2(g)+S(s) H4=____。 (用H1、 H2、H3表示)
(2)在恒溫、恒壓的容器中模擬回收硫,加入SO2起始量均為1mol,測得CO2的平衡體積分數隨CO和SO2的投料比變化如圖:

①當投料比為2時,t min 時測得SO2轉化率為50%,則用S的生成速率表示的反應速率v=______g·min-1。
②當投料比為3時,CO2 的平衡體積分數對應的點是______________。
(3)向體積均為1L的恒溫、恒客密團容器通入2 mol CO和| mol SO2。反應體系總壓強隨時間的變化如圖:
①相對于I,II改變的外界條件是____________________。
②SO2的平衡轉化率為______,平衡常數Kp =________(用平衡分壓代替平衡濃度計算)。
(4)利用電解法處理SO2尾氣可制備保險粉 (Na2S2O4).電解裝置如圖,則a____ b (填“>” “=”或“<”),生成S2O42-的電極反應式為____________________。

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com