
【題目】2一氨-3—氯苯甲酸是白色晶體,其制備流程如下:
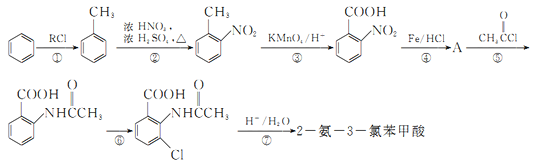
已知: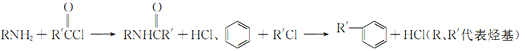
回答下列相關問題
(1)![]() 的名稱是__________,2-氨-3-氯苯甲酸中含N官能團的電子式為__________。
的名稱是__________,2-氨-3-氯苯甲酸中含N官能團的電子式為__________。
(2)反應①中R代表的是_____________,反應②的反應類型為_____________。
(3)如果反應③中KMnO4的還原產物為MnSO4,請寫出該反應的化學方程式_____________。
(4)A的結構簡式為_____________,⑥的反應條件為_____________。
(5)符合下列條件的同分異構體的結構簡式為_____________。
a.式量比![]() 大42的苯的同系物;
大42的苯的同系物;
b.與酸性KMnO4反應能生成二元羧酸
c.僅有3種等效氫
(6)事實證明上述流程的目標產物的產率很低;據此,研究人員提出將步驟⑥設計為以下三步,產率有了一定提高。
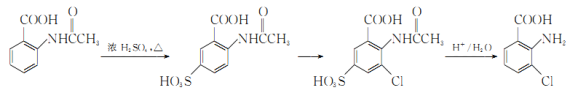
分析產率提高的原因是_____________。
【答案】甲苯 ![]() —CH3 取代反應
—CH3 取代反應 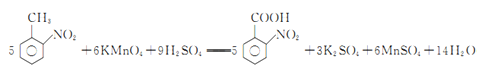
 Fe和Cl2
Fe和Cl2 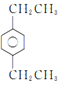 占位,減少5號位上H原子的取代
占位,減少5號位上H原子的取代
【解析】
由制備流程可知,苯與CH3Cl發生信息反應②生成甲苯,甲苯與濃硫酸和濃硝酸在加熱條件下發生硝化反應生成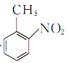 ,
, 發生氧化反應生成
發生氧化反應生成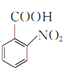 ,
, 與鐵、鹽酸發生還原反應生成A,則A為
與鐵、鹽酸發生還原反應生成A,則A為 ,
, 發生信息1反應生成
發生信息1反應生成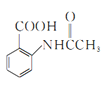 ,
, 在鐵作催化劑的條件下,與氯氣發生取代反應生成
在鐵作催化劑的條件下,與氯氣發生取代反應生成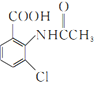 ,
, 在酸性條件下水解生成2一氨-3—氯苯甲酸。
在酸性條件下水解生成2一氨-3—氯苯甲酸。
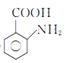
(1)![]() 的名稱是甲苯;2-氨-3-氯苯甲酸的結構簡式是
的名稱是甲苯;2-氨-3-氯苯甲酸的結構簡式是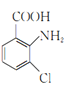 ,其含氮官能團為氨基,氨基的電子式為
,其含氮官能團為氨基,氨基的電子式為![]() ,故答案為:甲苯;
,故答案為:甲苯;![]() ;
;
(2)反應①為苯與CH3Cl反應生成甲苯,則R為—CH3;反應②為甲苯與濃硫酸和濃硝酸混酸在加熱條件下發生硝化反應生成 ,故答案為:—CH3;
,故答案為:—CH3; ;
;
(3)反應③中,KMnO4與![]() 發生氧化還原反應,KMnO4被還原為MnSO4,
發生氧化還原反應,KMnO4被還原為MnSO4,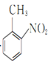 被氧化為
被氧化為![]() ,反應的化學方程式為
,反應的化學方程式為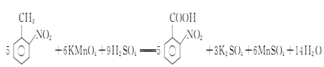 ,故答案為:
,故答案為: ;
;
(4) 與鐵、鹽酸發生還原反應生成A,則A為
與鐵、鹽酸發生還原反應生成A,則A為 ,反應⑥為
,反應⑥為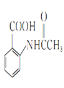 在鐵作催化劑的條件下,與氯氣發生取代反應生成
在鐵作催化劑的條件下,與氯氣發生取代反應生成 ,故答案為:
,故答案為: ;Fe和Cl2;
;Fe和Cl2;
(5)由a可知該物質比甲苯多3個—CH2—,由b可知該物質苯環上有2個取代基,其中取代基為—CH3和—CH2CH2CH3,在苯環上有鄰、間、對3種同分異構體,取代基為—CH3和—CH(CH3)2,在苯環上有鄰、間、對3種同分異構體,取代基為2個—CH2CH3,在苯環上有鄰、間、對3種同分異構體,共9種,其中有3中等效氫的結構簡式為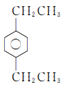 ,故答案為:
,故答案為: ;
;
(6)產率提高的原因是:占位可減少5號位上H原子的取代,減少副反應產物的生成,使得產率有了一定提高。故答案為:占位,減少5號位上H原子的取代。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】室溫下,Ka1(H2S)=1.3×10-7,Ka2(H2S)=7.1×10-15。不考慮溶液混合引起的體積變化和H2S的揮發,室溫時下列指定溶液中微粒物質的量濃度關系正確的是( )
A.0.1mol·L-1NaHS溶液:c(Na+)>c(HS-)>c(H2S)>c(S2-)
B.0.1mol·L-1Na2S溶液:c(OH-)=c(H+)+c(HS-)+c(H2S)
C.0.2mol·L-1NaHS溶液和0.1mol·L-1NaOH溶液等體積混合:c(HS-)+3c(H2S)>c(S2-)
D.向0.1mol·L-1NaOH溶液中通入H2S至溶液呈中性:c(Na+)=c(HS-)+c(S2-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各組數據中,前者剛好是后者兩倍的是( )
A.20% NaOH溶液中NaOH的物質的量濃度和10%NaOH溶液中NaOH的物質的量濃度
B.200mL1 molL-1氯化鈣溶液中c(C1-)和100 mL 2 molL-1氯化鉀溶液中c(Cl-)
C.2mol水的摩爾質量和1 mol水的摩爾質量
D.64g二氧化硫中氧原子數和標準狀況下22.4L一氧化碳中氧原子數
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】金屬氟化物一般都具有高容量、高質量密度的特點。氟離子熱電池是新型電池中的一匹黑馬,其結構如圖所示。下列說法正確的是
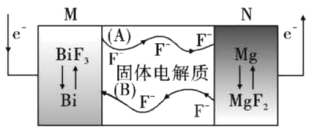
A. 圖示中與電子流向對應的氟離子移動方向是(B)
B. 電池放電過程中,若轉移1mol電子,則M電極質量減小12g
C. 電池充電過程中陽極的電極反應式為:B+3F--3e-=BiF3
D. 該電池需要在高溫條件下工作,目的是將熱能轉化為電能
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】PbCO3可用于油漆、陶瓷和玻璃等工業。由方鉛礦(主要成分為PbS,含有雜質FeS等)和軟錳礦(主要成分為MnO2)制備PbCO3的流程如下:
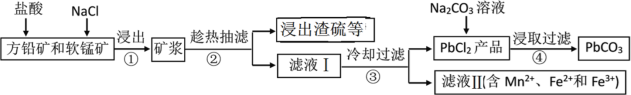
已知:PbCl2難溶于冷水和乙醇,易溶于熱水;各物質的溶度積見表。試回答下列問題:
物質 | Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | PbCl2 | PbS | PbCO3 |
Ksp | 2×10-13 | 8.0×10-16 | 1×10-38 | 1.6×10-5 | 8.0×10-28 | 7.4×10-14 |
(1)PbCO3的名稱是________。
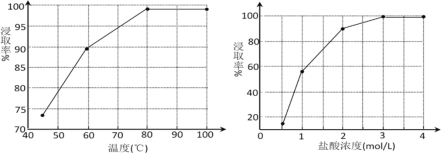
(2)步驟①中MnO2的作用是________,根據下圖分析過程①的最佳反應條件是_________。
(3)步驟②趁熱抽濾的原因是___________________。
(4)步驟③洗滌用的試劑是____________。
(5)將濾液Ⅱ先酸化,然后加入MnO2,反應的離子方程式為________;若反應后![]() ,進一步調節溶液的pH可分離出Fe3+和Mn2+,則調節溶液pH的范圍為_________
,進一步調節溶液的pH可分離出Fe3+和Mn2+,則調節溶液pH的范圍為_________![]() 時表示Fe3+已沉淀完全]。
時表示Fe3+已沉淀完全]。
(6)步驟④反應的離子方程式為______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】二氧化釩(VO2)是一種新型熱敏材料。+4價的釩化合物在弱酸性條件下易被氧化。實驗室以V2O5為原料合成用于制備VO2的氧釩(Ⅳ)堿式碳酸銨晶體,過程如下:

回答下列問題:
(1) VOC12中V的化合價為 ________。
(2)步驟i中生成VOC12的同時生成一種無色無污染的氣體,該化學方程式為___。也可只用濃鹽酸與V2O5來制備VOC12溶液,該法的缺點是 _______
(3)步驟ii可在下圖裝置中進行。

①反應前應通入CO2數分鐘的目的是 ________。
②裝置B中的試劑是____。
(4)測定氧釩(IV)堿式碳酸銨晶體粗產品中釩的含量。
稱量ag樣品于錐形瓶中,用20mL蒸餾水與30 mL混酸溶解后,加0.02 mol/LKMnO4溶液至稍過量,充分反應后繼續加1 %NaNO2溶液至稍過量,再用尿素除去過量的NaNO2,最后用c mol/L(NH4)2Fe(SO4)2標準溶液滴定至終點,消耗體積為b mL。滴定反應為:VO2++Fe2++2H+= VO2++Fe3++H2O.
①KMnO4溶液的作用是_______ 。NaNO2溶液的作用是______ 。
②粗產品中釩的質量分數的表達式為_________ 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】中國海軍航母建設正在有計劃、有步驟向前推進,第一艘國產航母目前正在進行海試。建造航母需要大量的新型材料。航母的龍骨要耐沖擊,航母的甲板要耐高溫,航母的外殼要耐腐蝕。
(1)鎳鉻鋼抗腐蝕性能強,Ni2+基態原子的核外電子排布為_______,鉻元素在周期表中______區。
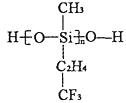
(2)航母甲板涂有一層耐高溫的材料聚硅氧烷結構如圖所示,其中C原子雜化方式為_______雜化。
(3)海洋是元素的搖籃,海水中含有大量鹵族元素。
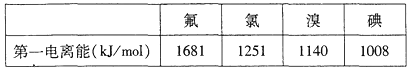
①根據下表數據判斷:最有可能生成較穩定的單核陽離子的鹵素原子是______填元素符號
②根據價層電子對互斥理論,預測ClO3-的空間構型為______形,寫出一個ClO3-的等電子體的化學符號______。
(4)海底金屬軟泥是在洋海底覆蓋著的一層紅棕色沉積物,蘊藏著大量的資源,含有硅、鐵、錳、鋅等。如右圖是從鐵氧體離子晶體Fe3O4中取出的能體現其晶體結構的一個立方體,則晶體中的離子是否構成了面心立方最密堆積?_____(填“是”或“否”);該立方體是不是Fe3O4的晶胞?______(填“是”或“否”);立方體中鐵離子處于氧離子圍成的_______(填空間結構)空隙;根據下圖計算Fe3O4晶體的密度為________g/cm3。(圖中a=0.42nm,計算結果保留兩位有效數字)
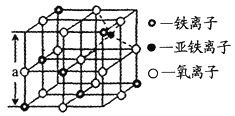
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】“暖冰”是科學家將水置于一個足夠強的電場中,在20℃時,水分子瞬間凝固形成的。用“暖冰”做了一個如圖所示的實驗,發現燒杯中酸性KMnO4溶液褪色。若將燒杯中的溶液換成含有少量KSCN的FeCl2溶液,溶液呈血紅色。則下列說法不正確的是( )
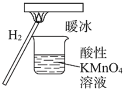
A.該條件下H2燃燒生成了既具有氧化性又具有還原性的物質
B.水凝固形成20℃時的“暖冰”所發生的變化是化學變化
C.該條件下H2燃燒的產物中可能含有一定量的H2O2
D.在電場作用下,水分子間更易形成氫鍵,因而可以制得“暖冰”
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】難溶物氫化亞銅(CuH)可用CuSO4溶液和“另一種反應物”在40℃~50℃時反應生成.CuH不穩定,易分解;CuH在氯氣中能燃燒;常溫下跟鹽酸反應能產生氣體,以下有關它的推斷中不正確的是()
A.“另一種反應物”一定具有氧化性B.CuH既可做氧化劑也可做還原劑
C.2CuH + 3Cl2![]() 2CuCl2 + 2HCl↑D.CuH+HCl=CuCl↓+H2↑
2CuCl2 + 2HCl↑D.CuH+HCl=CuCl↓+H2↑
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com