
| 溶質 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
| A. | 少量二氧化碳通入NaClO溶液中:2NaClO+CO2+H2O→Na2CO3+2HClO | |
| B. | 過量的 HCN滴入碳酸鈉溶液中 HCN+Na2CO3→NaCN+NaHCO3 | |
| C. | 結合質子能力由強到弱的順序為:HCO3->CN->C6H5O- | |
| D. | 常溫下電離常數:Ka2(H2CO3)>Ka(C6H5OH)>Ka (HCN) |
分析 相同濃度的鈉鹽溶液堿性越強,說明酸根離子水解程度越大,則相應酸的酸性越弱,酸的電離平衡常數越小,根據鈉鹽溶液的pH知,酸根離子水解程度CO32->C6H5O->CN->ClO->HCO3->CH3COO-,酸的電離平衡常數從小到大順序是:HCO3-<C6H5OH<HCN<HClO<H2CO3<CH3COOH,據此分析解答.
解答 解:A.酸性HCO3-<HClO,所以少量二氧化碳通入NaClO溶液中發生的反應為:NaClO+CO2+H2O=NaHCO3+HClO,故A錯誤;
B.酸性HCO3-<HCN<H2CO3,所以過量的HCN滴入碳酸鈉溶液中發生反應:HCN+Na2CO3=NaCN+NaHCO3,故B正確;
C.酸根離子水解程度越大,其結合質子能力越強,酸根離子水解程度CO32->C6H5O->CN->ClO->HCO3->CH3COO-,所以酸根離子結合質子能力大小順序是CO32->CN->HCO3->CH3COO-,故C錯誤;
D.酸根離子水解程度CO32->C6H5O->CN->ClO->HCO3->CH3COO-,酸的電離平衡常數從小到大順序是:HCO3-<C6H5OH<HCN<HClO<H2CO3<CH3COOH,故D錯誤;
故選B.
點評 本題考查了鹽類水解,明確酸根離子水解程度與酸的電離平衡常數、相同濃度鈉鹽溶液pH大小的關系是解本題關鍵,再結合強酸制取弱酸來分析解答,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | C2H6 | B. | C2H4 | C. | C3H6 | D. | C6H10 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①②⑤ | B. | ①④⑤ | C. | ①②③ | D. | ①②④ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
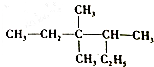
| A. | 2-乙基-3,3-二,甲基戊烷 | |
| B. | 3,3,4-三甲基己烷 | |
| C. | C的價電子軌道表示式:3,3-甲基-4乙基戊烷 | |
| D. | 2,3,3-三甲基己烷 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com