
【題目】易混易錯題組
物質在水中可能存在電離平衡、鹽類的水解平衡和沉淀的溶解平衡,它們都可看作化學平衡。請根據所學的知識回答:
(1)A為0.1 molL-1的(NH4)2SO4溶液,在該溶液中各種離子的濃度由大到小順序為________________________________________________。
(2)B為0.1 molL-1 NaHCO3溶液,在NaHCO3溶液中存在的各種平衡體系為(共3個,分別用離子方程式表示):_____________________________________________
(3)C為Al2(SO4)3溶液,實驗室中配制Al2(SO4)3溶液時通常需要向其中加入_______________,若把B和C溶液混合,將產生白色沉淀和無色氣體,該反應的離子方程式為___________________。
(4)pH=2的某酸HnA(An-為酸根)與pH=12的某堿B(OH)m混合,恰好反應生成正鹽,混合液pH=8,反應生成的正鹽的化學式為_________,鹽中________離子一定能水解,其第一步水解的離子方程式為_______________________。
【答案】 c(NH)>c(SO![]() )>c(H+)>c(OH-) HCO3-
)>c(H+)>c(OH-) HCO3-![]() H++CO32-、HCO3-+H2O
H++CO32-、HCO3-+H2O![]() H2CO3+OH-、H2O
H2CO3+OH-、H2O![]() H++OH- 硫酸 Al3++3HCO===Al (OH)3↓+3CO2↑ BnAm An-
H++OH- 硫酸 Al3++3HCO===Al (OH)3↓+3CO2↑ BnAm An- ![]()
![]()
【解析】試題分析:(1)硫酸銨是強酸弱堿鹽,銨根離子水解而使溶液呈酸性,再結合電荷守恒判斷離子濃度大小順序;(2)碳酸氫鈉溶液中存在水的電離平衡、碳酸氫根離子離子的電離平衡和水解平衡;(3)Al2(SO4)3易水解呈酸性,為防止其水解配制時要加入少量酸;碳酸氫鈉和Al2(SO4)3發生雙水解而生成氫氧化鋁沉淀和二氧化碳氣體;(4)根據化合價代數和等于0寫正鹽的化學式;混合液pH=8,說明為強堿弱酸鹽,酸根離子水解;
解析:(1)硫酸銨是強酸弱堿鹽,銨根離子水解而使溶液呈酸性,即c(H+)>c(OH-),溶液中存在電荷守恒c(NH4+)+c(H+)=2c(SO42-)+c(OH-),則c(NH4+)>c(SO42-),銨根離子水解較微弱,所以c(SO42-)>c(H+),則該溶液中離子濃度大小順序是c(NH4+)>c(SO42-)>c(H+)>c(OH-);(2)碳酸氫鈉溶液中存在碳酸氫根離子離子的電離平衡和水解平衡、水的電離平衡,離子方程式分別為:HCO3-H++CO32-、HCO3-+H2OH2CO3+OH-、H2OH++OH-;(3)Al2(SO4)3是強酸弱堿鹽,鋁離子水解而使其溶液呈酸性,為防止氯化鋁水解,所以在配制Al2(SO4)3溶液時向溶液中加入少量的硫酸,Al2(SO4)3和碳酸氫鈉發生雙水解反應而生成氫氧化鋁沉淀,同時生成二氧化碳氣體,離子反應方程式為Al3++3HCO===Al(OH)3↓+3CO2↑;
(4)根據化合價代數和等于0,該正鹽的化學式為BnAm;混合液pH=8,說明為強堿弱酸鹽,酸根離子水解,所以An-離子一定水解,第一步水解的離子方程式為![]()
![]() ;
;


科目:高中化學 來源: 題型:
【題目】從能量的變化和反應的快慢等角度研究反應:2H2+O2=2H2O。
(1)為了加快正反應速率,可以采取的措施有________(填序號,下同)。
A.使用催化劑 B.適當提高氧氣的濃度
C.適當提高反應的溫度 D.適當降低反應的溫度
(2)下圖能正確表示該反應中能量變化的是________。
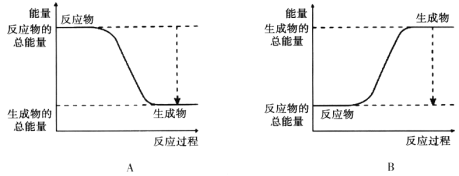
(3)從斷鍵和成鍵的角度分析上述反應中能量的變化。
化學鍵 | H—H | O=O | H—O |
鍵能kJ/mol | 436 | 496 | 463 |
請填寫下表:
化學鍵 | 填“吸收熱量”或“放出熱量” | 能量變化(kJ) | |
拆開化學鍵 | 2molH2化學鍵 | ________ | ________ |
1molO2化學鍵 | |||
形成化學鍵 | 4molH-O鍵 | ________ | ________ |
總能量變化 | ________ | ________ | |
(4)氫氧燃料電池的總反應方程式為2H2 +O2=2H2O。其中,氫氣在______極發生_______反應。電路中每轉移0.2mol電子,標準狀況下消耗H2的體積是______L。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室中需要配制2mol/L的NaCl溶液950mL,配制時應選用的容量瓶的規格和稱取的NaCl質量分別是( )
A.950 mL,111.2 g
B.500 mL,117 g
C.1 000 mL,117 g
D.任意規格,111.2 g
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】堿式碳酸鎂[4MgCO3·Mg(OH)2·4H2O]是重要的無機化工產品。一種由白云石[主要成分為CaMg(CO3)2,還含少量SiO2、Fe2O3等]為原料制備堿式碳酸鎂(國家標準中CaO的質量分數≤0.43%)的實驗流程如下:
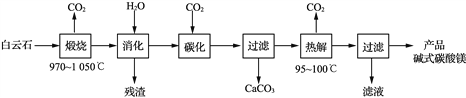
(1) “煅燒”時發生主要反應的化學方程式為____________________________。
(2)常溫常壓下“碳化”可使鎂元素轉化為Mg(HCO3)2,“碳化”時終點pH對最終產品中CaO含量及堿式碳酸鎂產率的影響如圖1和圖2所示。
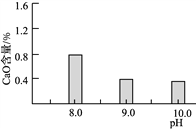
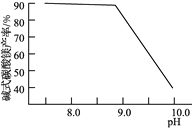
圖1 CaO含量與碳化終點pH的關系 圖2 堿式碳酸鎂產率與碳化終點pH的關系
①應控制“碳化”終點pH約為________,發生的主要反應的化學方程式為______________________和____________________。
②圖2中,當pH=10.0時,鎂元素的主要存在形式是____________(寫化學式)。
(3)“熱解”生成堿式碳酸鎂的化學方程式為________________________________。
(4)該工藝為達到清潔生產,可以循環利用的物質是____________(寫化學式)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】最近意大利羅馬大學的FuNvio Cacace等人獲得了極具理論研究意義的N4氣態分子。N4分子結構如圖所示,已知斷裂1molN-N吸收l67KJ的熱量,生成lmol N![]() N放出942KJ熱量。
N放出942KJ熱量。
(1)試寫出由N4氣態分子變成N2氣態分子的熱化學方程式:_____________________。
(2)某鹽N2H6Cl2的性質與NH4Cl類似,是離子化合物,其水溶液因分步水解而呈弱酸性。
①N2H6Cl2顯酸性原因(用離子方程式表示)__________________________。
②寫出足量金屬鎂加入鹽N2H6Cl2的溶液中產生H2的化學方程式為____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各組均為兩種化合物溶于水時電離出的離子,其中由酸電離的是( )
A.Na+、OH﹣、SO42﹣
B.H+、Cl﹣、SO42﹣
C.Na+、K+、OH﹣
D.Na+、K+、NO3﹣
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某有機物的結構簡式如圖所示,下列有關該有機物的說法中正確的是

A. 能和碳酸鈉溶液反應的官能團有2種
B. 1mol該有機物最多能與2molH2發生加成
C. 與![]() 互為同分異構體
互為同分異構體
D. 既可以發生取代反應又可以發生氧化反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用下列實驗裝置完成對應的實驗,能達到實驗目的的是
A. 制取并收集少量氨氣 
B. 比較NaHCO3和Na2CO3的熱穩定性
C. 制取并檢驗乙烯
D. 比較鹽酸、碳酸、硅酸的酸性強弱
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下圖是2SO3(g)![]() 2SO2(g)+O2(g)的能量變化圖,據圖得出的相關敘述正確的是( )
2SO2(g)+O2(g)的能量變化圖,據圖得出的相關敘述正確的是( )
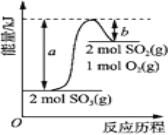
A. 該化學反應過程中既有能量的吸收又有能量的釋放
B. 2SO3(g)![]() 2SO2(g)+O2(g) △H=-(a-b) kJ/mol
2SO2(g)+O2(g) △H=-(a-b) kJ/mol
C. 1 mol SO2的能量比1 mol SO3的能量高
D. 若某容器內有2 mol SO3充分反應,吸收(a-b) kJ熱量
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com