
分析 (1)摩爾質量以g/mol為單位,數值上等于其相對分子質量;根據n=$\frac{m}{M}$計算甲烷物質的量,再根據N=nNA計算甲烷分子數目;根據V=nVm計算甲烷體積;根據H原子數目相等計算甲烷、氨氣物質的量之比,根據m=nM計算氨氣質量,進而計算二者質量之比;同溫同壓下,氣體的密度之比等于其摩爾質量之比;根據n=$\frac{m}{M}$計算甲烷、氨氣的物質的量之比,同溫同壓下,氣體體積之比等于其物質的量之比;
(2)根據n=$\frac{m}{M}$計算CO、H2的物質的量之比,根據n=$\frac{V}{{V}_{m}}$計算CO、H2的總物質的量,進而計算CO物質的量,再根據V=nVm計算CO的體積;
(3)根據V=$\frac{m}{ρ}$計算溶液體積,根據n=$\frac{m}{M}$計算Al3+的物質的量,溶液中n(Cl-)=3n(Al3+),再根據c=$\frac{n}{V}$計算c(Cl-);
(4)根據c=$\frac{1000ρω}{M}$計算.
解答 解:(1)甲烷的摩爾質量為16g/mol;8g CH4 的物質的量為$\frac{8g}{16g/mol}$=0.5mol,含有分子數目為0.5mol×NAmol-1=0.5NA,在標準狀況下所占的體積約為0.5mol×22.4L/mol=11.2L;所含氫原子數相等的甲烷和氨氣(NH3)的物質的量之比為$\frac{1}{4}$:$\frac{1}{3}$=3:4,二者質量比為3mol×16g/mol:4mol×17g/mol=12:17;同溫同壓下,氣體的密度之比等于其摩爾質量之比,甲烷和氨氣密度之比為16g/mol:17g/mol=16:17;根據n=$\frac{m}{M}$可知,質量相等的甲烷和氨氣的物質的量之比為17g/mol:16g/mol=17:16,二者體積之比為17:16,
故答案為:16g/mol;0.5NA;11.2;12:17;16:17;17:16;
(2)CO、H2的物質的量之比為$\frac{49}{28}$:$\frac{4}{2}$=49:56,CO、H2的總物質的量為$\frac{33.6L}{22.4L/mol}$=1.5mol,則CO物質的量為1.5mol×$\frac{49}{49+56}$,故CO的體積為1.5mol×$\frac{49}{49+56}$×22.4L/mol=15.68L,
故答案為:15.68L;
(3)溶液體積為$\frac{30g}{1000dg/L}$=$\frac{3}{100d}$L,Al3+的物質的量為$\frac{0.9g}{27g/mol}$=$\frac{1}{30}$mol,溶液中n(Cl-)=3n(Al3+)=0.1mol,則c(Cl-)=$\frac{0.1mol}{\frac{3}{100d}L}$=$\frac{10d}{3}$mol/L,
故答案為:$\frac{10d}{3}$mol/L;
(4)根據c=$\frac{1000ρω}{M}$可知,密度為1.17g•mL-1,質量分數為36.5%的濃鹽酸的物質的量濃度為$\frac{1000×1.17×36.5%}{36.5}$mol/L=11.7mol/L,
故答案為:11.7mol/L.
點評 本題考查物質的量有關計算,注意掌握以物質的量為中心的基礎,有利于基礎知識的鞏固.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:選擇題
| A. | 硫酸銅溶液與氫氧化鋇溶液反應:Ba2++SO42-═BaSO4↓ | |
| B. | 鐵與稀硫酸反應:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 鈉與水的反應:Na+2H2O═Na++2OH-+H2↑ | |
| D. | 向KHSO4溶液中加入Ba(OH)2溶液至恰好沉淀完全:Ba2++H++SO42-+OH-═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 石蠟油(17個碳原子以上的液態烷烴混合物)的分解實驗裝置如圖所示.在試管①中加入石蠟油和氧化鋁(催化石蠟油分解);試管②放在冷水中;試管③中加入溴的四氯化碳溶液.
石蠟油(17個碳原子以上的液態烷烴混合物)的分解實驗裝置如圖所示.在試管①中加入石蠟油和氧化鋁(催化石蠟油分解);試管②放在冷水中;試管③中加入溴的四氯化碳溶液. ;
; .
. ,該反應的反應類型為加成反應.
,該反應的反應類型為加成反應.查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用酒精燈給錐形瓶加熱來濃縮溶液 | |
| B. | 蒸餾實驗開始時先通入冷凝水,再點燃酒精燈加熱 | |
| C. | 只有分液漏斗才能進行碘水中的碘的萃取實驗 | |
| D. | 濃硫酸燒傷皮膚應用大量水沖洗,然后涂上少量氫氧化鈉溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
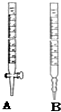 某工廠廢水中含游離態氯,通過下列實驗測定其濃度
某工廠廢水中含游離態氯,通過下列實驗測定其濃度查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①②④ | B. | ①②③④ | C. | ①②③④⑥ | D. | 全部 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
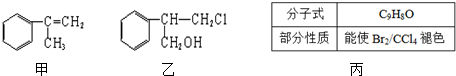

 +HCl$\stackrel{一定條件}{→}$
+HCl$\stackrel{一定條件}{→}$ (不需注明反應條件).
(不需注明反應條件).
 .
. 、
、 、
、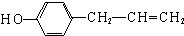 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com