
| A. | 8+$\frac{1}{2}$ lg2 | B. | 9+lg2 | C. | 10+$\frac{1}{2}$ lg2 | D. | 11+2lg2 |
分析 Mn2+沉淀較為完全時,c(Mn2+)≤1×10-5mol/L,根據Ksp求出OH-離子的濃度,再根據Kw求出氫離子的濃度,然后計算出pH,據此進行計算.
解答 解:Mn2+沉淀較為完全時的濃度≤1×10-5mol/L,已知Ksp=c(Mn2+)×c2(OH-),
則c(OH-)≥$\sqrt{\frac{{K}_{sp}}{c(M{n}^{2+})}}$=$\sqrt{\frac{2×1{0}^{-13}}{1×1{0}^{-5}}}$mol/L=$\sqrt{2}$×10-4mol/L,
則c(H+)≤$\frac{{K}_{W}}{c(O{H}^{-})}$=$\frac{1×1{0}^{-14}}{\sqrt{2}×1{0}^{-4}}$mol/L=$\frac{\sqrt{2}}{2}$×10-10mol/L,
所以pH≥-lg$\frac{\sqrt{2}}{2}$×10-10=10+$\frac{1}{2}$lg2,
故選C.
點評 本題考查溶度積常數及溶液pH的計算,題目難度中等,注意掌握難溶物溶度積常數的概念及計算方法,明確Mn2+沉淀較為完全時c(Mn2+)≤1×10-5mol/L為解答關鍵.


科目:高中化學 來源: 題型:解答題
 A、B、C、D、E五種元素是周期表中前四周期的元素.只有A、B、C為金屬且同周期,原子序數A<B<C.A、C核外均沒有未成對電子;B原子核外有二個未成對電子和三個空軌道.D原子最外層電子數是其周期序數的三倍.E能與D形成化合物ED2,可用于自來水的消毒.
A、B、C、D、E五種元素是周期表中前四周期的元素.只有A、B、C為金屬且同周期,原子序數A<B<C.A、C核外均沒有未成對電子;B原子核外有二個未成對電子和三個空軌道.D原子最外層電子數是其周期序數的三倍.E能與D形成化合物ED2,可用于自來水的消毒.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 所含質子數=A-n | B. | 所含中子數=A-Z | C. | 所含電子數=Z+n | D. | 質量數=Z+A |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用新制氫氧化銅懸濁液能鑒別葡萄糖、甘油、乙醛、乙酸 | |
| B. | 用酸性高錳酸鉀即可檢驗CH2=CHCHO中的碳碳雙鍵 | |
| C. | 為檢驗氯乙烷中的氯元素,在水解液中滴加稀硫酸酸化,再滴入AgNO3溶液,產生白色沉淀 | |
| D. | 用溴水即可鑒別溴苯、苯、己烯與苯酚 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Zn(l)=Zn(g)△H=$\frac{1}{2}$(△H1-△H2 ) | |
| B. | 用硅制作的太陽能電池是將化學能轉化為電能 | |
| C. | 增加Zn(g)的量,△H2變大 | |
| D. | 以Zn片、銅片和稀硫酸構成的原電池,Zn片表面有氣泡產生. |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
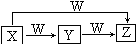 X、Y、Z、W均為中學化學常見物質,一定條件下它們有如圖所示的轉化關系(某些產物已略去),下列說法錯誤的是( )
X、Y、Z、W均為中學化學常見物質,一定條件下它們有如圖所示的轉化關系(某些產物已略去),下列說法錯誤的是( )| A. | 若X為HNO3,則W可能為Fe | |
| B. | 若W為O2,X可能是S | |
| C. | 若W為O2,則Z可能為NO | |
| D. | X→Z的離子反應可能為Al3++4OH-=AlO2-+2H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
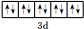
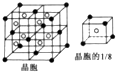 已知A、B、C、D、E、F是周期表中前四周期的六種元素,它們的性質或結構信息如表,請根據信息回答下列問題:
已知A、B、C、D、E、F是周期表中前四周期的六種元素,它們的性質或結構信息如表,請根據信息回答下列問題:| 元素 | 性質或結構信息 |
| A | 單質為黃色粉末,難溶于水,能形成2種二元含氧酸 |
| B | M層有1個未成對的p電子,核外電子總數大于7 |
| C | 與鋰形成的合金常用于航天飛行器,單質能溶于強酸和強堿 |
| D | S電子總數比p電子總數少2個,單質或氧化物均具有很高的熔、沸點 |
| E | 周期表中電負性最大的元素 |
| F | 最外層有2個電子,但次外層有18個電子 |
 .
.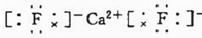 .已知該化合物晶胞$\frac{1}{8}$的體積為2.0×10-23cm3,該離子化合物的密度為3.2g/cm3(保留一位小數).
.已知該化合物晶胞$\frac{1}{8}$的體積為2.0×10-23cm3,該離子化合物的密度為3.2g/cm3(保留一位小數).查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用氫氟酸在玻璃上鐫刻圖案:4I++SiO2═H2O+Si4+ | |
| B. | 向Cu2+、Fe3+混合液中加入CuO除去Fe3+;3H2O+3CuO+2Fe3+═2Fe(OH)3+3Cu2+ | |
| C. | 亞硫酸氫鈉溶液顯酸性:HSO3-═H++SO32- | |
| D. | 用鹽酸與碳酸鈉反應證明氯的非金屬性強與炭:2H++CO32-═CO2↑+H2O |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com