
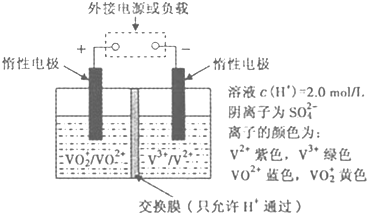
分析 (1)二氧化硫和氧氣反應方程式為2SO2(g)+O2(g)?2SO3(g),開始時沒有SO3,根據方程式知,反應c(SO2)(消耗)=c(SO3)(生成)=bmol/L,則SO2 起始物質的量濃度=c(SO2)(消耗)+c(SO2)(剩余)=生成v(SO3)=$\frac{△c}{△t}$;
(2)①左槽溶液逐漸由黃變藍,VO2+轉變為VO2+,發生還原反應,應為原電池的正極,
②充電過程中,右槽連接電源的負極,發生還原反應,為電解池的陰極,電極反應式為V3++e-=V2+,
③充電時,左槽發生的反應為VO2++H2O-e-=VO2++2H+當轉移電子為3.01×1023個即為0.5 mol電子時,生成氫離子為0.5 mol.
解答 解:(1)二氧化硫和氧氣反應方程式為2SO2(g)+O2(g)?2SO3(g),開始時沒有SO3,根據方程式知,反應c(SO2)(消耗)=c(SO3)(生成)=bmol/L,則SO2 起始物質的量濃度=c(SO2)(消耗)+c(SO2)(剩余)=bmol/L+amol/L=(a+b)mol/L;
生成v(SO3)=$\frac{△c}{△t}$=$\frac{bmol/L}{tmin}$=$\frac{b}{t}$mol/L,
故答案為:a+b;$\frac{b}{t}$;
(2)①當左槽溶液逐漸由黃變藍,其電極反應式為VO2++2H++e-=VO2++H2O,說明此時為原電池,且為原電池的正極,故答案為:VO2++2H++e-=VO2++H2O;
②充電過程中,右槽連接的是電源負極,為電解池的陰極,電極反應式為V3++e-=V2+,V3+為綠色,V2+為紫色,
故可以看到右槽溶液顏色逐漸由綠色變為紫色.
故答案為:綠;紫;
③放電過程中,電極反應式為VO2++2H++e-=VO2++H2O,氫離子的作用是充電時,參與正極反應,通過交換膜定向移動使溶液成電中性;左槽發生的反應為VO2++H2O=VO2++2H++e-,當轉移電子為3.01×1023個即為0.5 mol電子時,生成氫離子為0.5mol;氫離子變化0.5mol;
故答案為:參與正極反應;通過交換膜定向移動使溶液成電中性;0.5mol.
點評 本題考查化學平衡計算、原電池和電解池原理,為高頻考點,側重考查學生分析判斷能力,難點是電極反應式的書寫,注意結合電解質溶液酸堿性書寫,題目難度不大.


 全能練考卷系列答案
全能練考卷系列答案科目:高中化學 來源: 題型:選擇題
| A. | 向碳酸氫鈣溶液中加過量氫氧化鈉Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32- | |
| B. | 等體積等物質的量濃度的氫氧化鋇溶液與碳酸氫銨溶液混合Ba2++OH-+HCO3-═BaCO3↓+H2O | |
| C. | 氯化鋁與過量氨水反應 Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| D. | 過量CO2通入氫氧化鋇的稀溶液中 CO2+OH-═HCO3- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
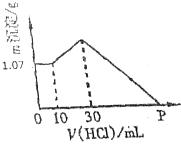 把NaOH、AlCl3、FeCl3三種固體組成的混合物熔于足量水中后,有1.07g沉淀,在所得溶液中逐滴加入0.5mol/L鹽酸,加入鹽酸體積與生成沉淀的質量關系如圖所示,試求
把NaOH、AlCl3、FeCl3三種固體組成的混合物熔于足量水中后,有1.07g沉淀,在所得溶液中逐滴加入0.5mol/L鹽酸,加入鹽酸體積與生成沉淀的質量關系如圖所示,試求查看答案和解析>>
科目:高中化學 來源: 題型:解答題
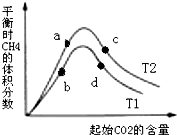 有科學家提出“綠色自由”的構想:將CO2變為燃料或有機化學品.其構想分成3個步驟:
有科學家提出“綠色自由”的構想:將CO2變為燃料或有機化學品.其構想分成3個步驟:查看答案和解析>>
科目:高中化學 來源: 題型:填空題
| 實驗組 | 溫度 ℃ | 起始量/mol | 平衡量/mol | 達到平衡所需時間/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用物質A表示的反應的平均速率為 0.6 mol•L-1•s-1 | |
| B. | 用物質B表示的反應的平均速率為 0.6 mol•L-1•s-1 | |
| C. | 2 s 時物質A的轉化率為70% | |
| D. | 2 s 時物質B的濃度為 0.7 mol•L-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 利用布朗運動可區別溶液和膠體 | |
| B. | 溶液中通過一束光線時沒有明顯現象,膠體中通過一束光線時出現明顯的光路 | |
| C. | 膠體微粒帶電荷,溶液中溶質微粒不帶電荷 | |
| D. | 制備Fe(OH)3膠體的方法是:將飽和FeCl3溶液通入熱的NaOH溶液中并持續煮沸 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
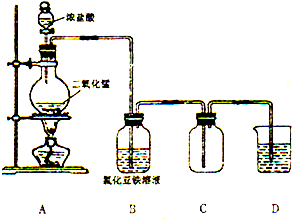 某化學研究型學習小組利用以下裝置制取并探究氯氣的性質.【裝置A中發生反應的化學方程式:MnO2+4HCl(濃)═MnCl2+Cl2↑+2H2O】
某化學研究型學習小組利用以下裝置制取并探究氯氣的性質.【裝置A中發生反應的化學方程式:MnO2+4HCl(濃)═MnCl2+Cl2↑+2H2O】查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com