
| A. | Ca(ClO)2溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O=CaSO4↓+H++Cl-+HClO | |
| B. | 向FeCl2溶液加入足量NaClO溶液:6Fe2++3ClO-+3H2O=2Fe(OH)3↓+4Fe3++3Cl- | |
| C. | NH4HCO3溶液和少量的NaOH溶液混合:HCO3-+OH-═CO32-+H2O | |
| D. | 向Fe(NO3)3溶液中加入足量的HI溶液:2Fe3++2I-=2Fe2++I2 |
分析 A.發生氧化反應生成硫酸鈣,遵循電子、電荷守恒;
B.Fe2+與ClO-會發生氧化還原反應,生成的氫離子與次氯酸根離子結合生成次氯酸;
C.少量NaOH與碳酸氫根離子反應;
D.漏寫硝酸根離子發生的氧化還原反應.
解答 解:A.Ca(ClO)2溶液中通入少量SO2的離子反應為Ca2++2ClO-+SO2+H2O=CaSO4↓+H++Cl-+HClO,故A正確;
B.向FeCl2溶液加入足量NaClO溶液的離子反應為2Fe2++5ClO-+5H2O═2Fe(OH)3↓+Cl-+4HClO,故B錯誤;
C.NH4HCO3溶液和少量的NaOH溶液混合的離子反應為HCO3-+OH-═CO32-+H2O,故C正確;
D.向Fe(NO3)3溶液中加入足量的HI溶液的離子反應為3NO3-+12H++Fe3++10I-=Fe2++3NO↑+6H2O+5I2,故D錯誤;
故選AC.
點評 本題考查離子反應方程式的書寫,為高頻考點,把握發生的反應及離子反應的書寫方法為解答的關鍵,側重分析與應用能力的考查,注意離子反應中保留化學式的物質及電子、電荷守恒,題目難度不大.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | mg的CO和H2混合氣體充分燃燒后,生成的氣體通入Na2O2固體中,固體質量增重mg | |
| B. | 將一定量的CO2氣體通入足量的Na2O2固體中,固體量增重2.8g,則反應中有0.1mol電子轉移 | |
| C. | 相同質量的鋁分別與足量的鹽酸和NaOH溶液反應,生成氣體物質的量之比為1:3 | |
| D. | NaAlO2溶液中逐滴滴入鹽酸至過量,生成的沉淀隨著加入的元素所發生的變化如圖所示: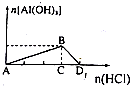 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
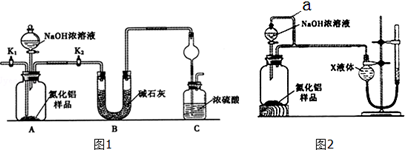

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
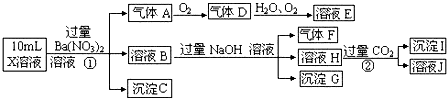
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
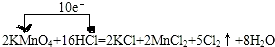 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
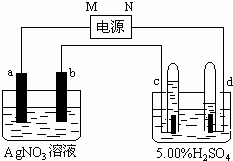 如圖中電極a、b分別為Ag電極和Pt電極,電極c、d都是石墨電極.通電一段時間后,在c、d兩極上共收集到336mL(標準狀態)氣體.請回答下列問題.
如圖中電極a、b分別為Ag電極和Pt電極,電極c、d都是石墨電極.通電一段時間后,在c、d兩極上共收集到336mL(標準狀態)氣體.請回答下列問題.查看答案和解析>>
科目:高中化學 來源: 題型:實驗題

| 物質 | 熔點/℃ | 沸點/℃ | 其他 |
| CCl4 | -23 | 76 | 與TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮濕空氣產生白霧 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com