
| A. | Fe和Mg與0.1 mol•L-1的鹽酸反應,反應速率相同 | |
| B. | 0.1 mol•L-1的鹽酸與H2SO4分別與大小、形狀相同的大理石反應,反應速率相同 | |
| C. | 催化劑能降低分予活化時所需能量,使單位體積內活化分子百分數大大增加 | |
| D. | 100Ml 2mol•L-1的鹽酸與鋅片反應,加入適量的NaCl溶液,反應速率不變 |
分析 A.物質的性質為決定化學反應速率的主要因素;
B.硫酸與大理石生成微溶于水的硫酸鈣;
C.催化劑降低反應的活化能,增大活化分子百分數;
D.溶液體積增大,濃度減小.
解答 解:A.鎂比鐵活潑,與鹽酸反應速率較大,故A錯誤;
B.硫酸與大理石生成微溶于水的硫酸鈣,覆蓋在大理石的表面,阻礙反應的進行,反應較慢,故B錯誤;
C.催化劑降低反應的活化能,增大活化分子百分數,可增大反應速率,故C正確;
D.加入氯化鈉溶液,溶液體積增大,濃度減小,反應速率減小,故D錯誤.
故選C.
點評 本題考查影響化學反應速率的因素,為高頻考點,側重學生的分析能力與基本理論知識的考查,注意外因因素變化與活化分子數目、百分數變化的關系,題目難度中等.


 金牌教輔培優優選卷期末沖刺100分系列答案
金牌教輔培優優選卷期末沖刺100分系列答案科目:高中化學 來源: 題型:選擇題
| A. | 淀粉、纖維素水解的最終產物都是葡萄糖 | |
| B. | 誤服可溶性重金屬鹽,立即服用大量牛奶可以解毒 | |
| C. | 用灼燒的方法可鑒別毛織物和棉織物 | |
| D. | 溫度越高,酶對某些化學反應的催化效率越高 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 增大壓強,平衡常數將增大 | |
| B. | 達到平衡時,單位時間里消耗n mol S2Cl2的同時也生成n molCl2 | |
| C. | 達到平衡時,若升高溫度,氯氣的百分含量減小 | |
| D. | 加入氯氣,平衡向正反應方向移動,氯氣的轉化率一定升高 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
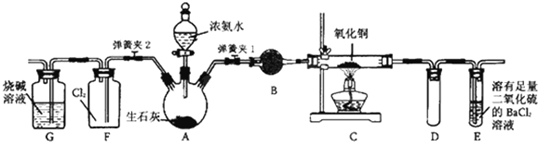
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 改進汽車尾氣凈化技術,可以減少大氣污染物的排放 | |
| B. | PM2.5是指大氣中直徑小于或等于2.5微米的顆粒物,是霧霾天氣產生的主要原因 | |
| C. | 推廣燃煤脫硫技術,可以降低SO2對大氣的污染 | |
| D. | CO、SO2、NO、NO2都是對大氣產生污染的氣體,它們在空氣中都能穩定存在 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 基態Mg原子的核外電子排布圖: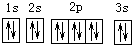 | |
| B. | 過氧化氫的電子式: | |
| C. | As原子的簡化電子排布式:[Ar]4s24p3 | |
| D. | 羥基的電子式: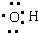 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com